Η Ακίδα Πρωτεΐνης (The Spike Protein)
Μετάφραση: Απολλόδωρος
12 Ιουλίου 2022 | ViroLIEgy | Διαβάστε το εδώ
Μπορείτε να κάνετε εφάπαξ ή επαναλαμβανόμενες δωρεές μέσω του Ko-Fi:
Συχνά μου θέτουν πολλές ερωτήσεις σχετικά με τη λεγόμενη ακίδα πρωτεΐνης του " κορονοϊού", όπως το αν υπάρχει ή όχι και αν υπάρχει πράγματι στο εμβόλιο. Έχει αυτό το σωματίδιο οποιαδήποτε βιολογική σημασία ή είναι απλώς ένα ακόμη από μια μακρά σειρά απεικονίσεων που χρησιμοποιούνται για τη δημιουργία φόβου; Αν κάποιος δεν γνωρίζει σε αυτό το σημείο, η ακίδα πρωτεΐνης λέγεται ότι είναι οι προεξοχές 9-12 nm που φαίνονται σε εικόνες TEM (Ηλεκτρονικό Μικροσκόπιο Διέλευσης -ΗΜΔ) του "ιού" και του δίνουν την εμφάνιση ακίδας ή "κορώνας" γύρω από τις εξωτερικές άκρες. Σύμφωνα με τη μυθολογία, αυτές οι πρωτεΐνες επιτρέπουν στον "ιό" να διεισδύσει στο κύτταρο-ξενιστή και να ξεκινήσει τη διαδικασία μόλυνσης. Η ακίδα της πρωτεΐνης έχει αναδειχθεί λόγω της συνεχιζόμενης προπαγάνδας γύρω από τα εμβόλια mRNA, τα οποία ισχυρίζονται ότι παράγουν την ακίδα στο σώμα μετά την ένεση. Αυτό λέγεται ότι πυροδοτεί μια ανοσολογική απόκριση η οποία διδάσκει στον οργανισμό πώς να προετοιμάσει μια στρατιά αντισωμάτων για να καταπολεμήσει κάθε ύπουλη παραλλαγή stealh... ή όχι. Εξαρτάται από την παραλλαγή, τον κατασκευαστή, τη δόση, το πρόγραμμα, την έκβαση της νόσου κ.λπ.
Σύμφωνα με τον ΠΟΥ:
"Στοιχεία σχετικά με την αποτελεσματικότητα των εμβολίων (VE) κατά της συμπτωματικής ασθένειας και της σοβαρής νόσου αναμένεται να γίνουν διαθέσιμα μόνον όταν τα εμβόλια που έχουν επικαιροποιηθεί με παραλλαγές θα έχουν εισαχθεί σε ευρύτερη χρήση".
"Τα επί του παρόντος διαθέσιμα εμβόλια COVID-19 βασίζονται στον ιό δείκτη (που αναφέρεται επίσης ως το προγονικό στέλεχος)- ωστόσο, υπήρξε συνεχής και σημαντική εξέλιξη του ιού SARS CoV-2, ιδίως στην ακίδα (S) της πρωτεΐνης. Αυτές οι γονιδιωματικές αλλαγές στον ιό οδήγησαν σε διάφορες VOC (ανησυχητικές παραλλαγές) που κυκλοφόρησαν κατά κύματα, με ποικίλους βαθμούς ανοσολογικής αποφυγής, μερικές από τις οποίες είχαν ως αποτέλεσμα χαμηλότερη VE (αποτελεσματικότητα του εμβολίου) των υφιστάμενων εμβολίων COVID-19 σε σύγκριση με την αρχική VE έναντι του ιού δείκτη. Το μέγεθος της μείωσης της VE ποικίλλει ανάλογα με το προϊόν, το πρόγραμμα, την έκβαση της νόσου, τον VOC και το χρόνο από την τελευταία δόση. Από τον Ιανουάριο έως τον Ιούνιο του 2022, η κυρίαρχη παραλλαγή του SARS-CoV-2 παγκοσμίως ήταν η παραλλαγή Omicron, με την εμφάνιση πρόσθετων υπο-γραμμών (1). Η παραλλαγή Omicron είναι η πιο αντιγονικά διακριτή παραλλαγή από τον ιό δείκτη και έχει παρουσιάσει τον υψηλότερο βαθμό ανοσολογικής αποφυγής στα τρέχοντα εμβόλια COVID-19, σε σύγκριση με τον ιό δείκτη. Τα τρέχοντα εμβόλια συνεχίζουν να αποδίδουν καλά στην πρόληψη σοβαρής νόσου και θανάτου λόγω του Omicron, ιδίως με τη χρήση αναμνηστικής δόσης (ή αναμνηστικών δόσεων). Ωστόσο, η προστασία από τη μόλυνση και τη συμπτωματική νόσο λόγω της παραλλαγής Omicron είναι χαμηλότερη από άλλες παραλλαγές και μειώνεται γρήγορα, ακόμη και μετά από μια τρίτη (αναμνηστική) δόση. Αυτοί που διατρέχουν τον υψηλότερο κίνδυνο για σοβαρή νόσο, νοσηλεία και θάνατο παραμένουν τα ηλικιωμένα άτομα, τα άτομα με συννοσηρότητες και ανοσοκατασταλτικές καταστάσεις και άλλοι ευάλωτοι πληθυσμοί, όπως περιγράφεται στον οδικό χάρτη προτεραιοτήτων του ΠΟΥ (2)".
Ο ΠΟΥ αναφέρει ότι η αποτυχία των εμβολίων οφείλεται στις συνεχείς και ταχείες αλλαγές της ακίδας της πρωτεΐνης καθώς εξελίσσεται και αποφεύγει τις άμυνες του ανοσοποιητικού συστήματος. Αυτή η καταπληκτική υπερδύναμη μας έχει αφήσει ακριβώς στην ίδια κατάσταση στην οποία βρισκόμασταν πριν από τη χρήση των τοξικών εμβολίων πριν από δύο και πλέον χρόνια: ο "ιός" εξακολουθεί να αλωνίζει, το 99% του πληθυσμού που δεν κινδύνευσε ποτέ δεν κινδυνεύει και όσοι είχαν αυξημένο κίνδυνο να νοσήσουν παραμένουν έτσι. Ωστόσο, τώρα έχουμε πολλούς που τραυματίζονται άσκοπα από ένα εμβόλιο που δεν αποδείχθηκε ποτέ ότι είναι ασφαλές και αποτελεσματικό, χωρίς δεδομένα για τη μακροπρόθεσμη ασφάλεια. Είναι σαφές ότι το εμβόλιο δεν προσέφερε ποτέ καμία προστασία. Η ιστορία που δημιουργήθηκε γύρω από τον τρόπο με τον οποίο υποτίθεται ότι λειτουργεί η θεωρητική ακίδα πρωτεΐνης δεν είναι παρά καθαρή φαντασία που αποδίδεται σε μια μη παρατηρήσιμη διαδικασία που λέγεται ότι συμβαίνει στο εσωτερικό του σώματος μετά την ένεση.
Σύμφωνα με το CDC:
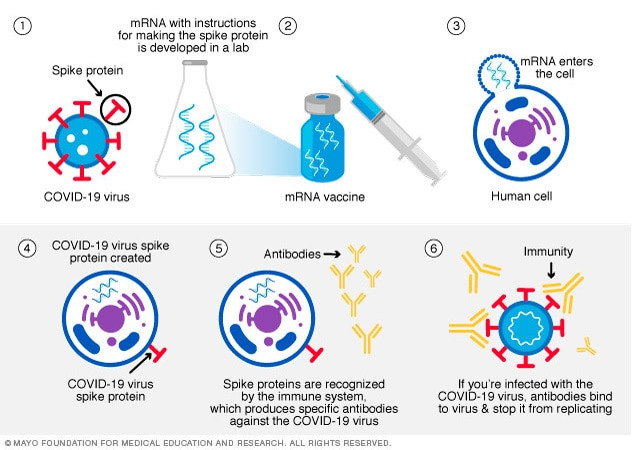
"Για να προκαλέσουν μια ανοσολογική απόκριση, πολλά εμβόλια εισάγουν στο σώμα μας ένα εξασθενημένο ή αδρανοποιημένο μικρόβιο. Όχι τα εμβόλια mRNA. Αντίθετα, τα εμβόλια mRNA χρησιμοποιούν mRNA που δημιουργείται σε ένα εργαστήριο για να διδάξουν στα κύτταρά μας πώς να φτιάξουν μια πρωτεΐνη -ή ακόμη και μόνο ένα κομμάτι μιας πρωτεΐνης- που πυροδοτεί μια ανοσολογική απόκριση μέσα στο σώμα μας. Αυτή η ανοσολογική απόκριση, η οποία παράγει αντισώματα, είναι αυτό που μας βοηθά να προστατευτούμε από το να αρρωστήσουμε από το συγκεκριμένο μικρόβιο στο μέλλον.
1. Αρχικά, τα εμβόλια mRNA COVID-19 χορηγούνται στον μυ του άνω βραχίονα. Μετά τον εμβολιασμό, το mRNA θα εισέλθει στα μυϊκά κύτταρα. Μόλις εισέλθουν, χρησιμοποιούν τους μηχανισμούς των κυττάρων για να παράγουν ένα ακίνδυνο κομμάτι αυτού που ονομάζεται ακίδα πρωτεΐνης. Η ακίδα πρωτεΐνης βρίσκεται στην επιφάνεια του ιού που προκαλεί τον COVID-19. Αφού παραχθεί το κομμάτι της πρωτεΐνης, τα κύτταρά μας διασπούν το mRNA και το απομακρύνουν.
2. Στη συνέχεια, τα κύτταρά μας εμφανίζουν το κομμάτι της ακίδας πρωτεΐνης στην επιφάνειά τους. Το ανοσοποιητικό μας σύστημα αναγνωρίζει ότι η πρωτεΐνη δεν ανήκει εκεί. Αυτό ενεργοποιεί το ανοσοποιητικό μας σύστημα να παράγει αντισώματα και να ενεργοποιήσει άλλα ανοσοποιητικά κύτταρα για να καταπολεμήσει αυτό που νομίζει ότι είναι μόλυνση. Αυτό μπορεί να κάνει ο οργανισμός σας αν αρρωστήσετε από το COVID-19.
3. Στο τέλος της διαδικασίας, το σώμα μας έχει μάθει πώς να προστατεύεται από μελλοντική μόλυνση από τον ιό που προκαλεί το COVID-19. Το πλεονέκτημα είναι ότι οι άνθρωποι λαμβάνουν αυτή την προστασία από ένα εμβόλιο, χωρίς να χρειάζεται ποτέ να διακινδυνεύσουν τις δυνητικά σοβαρές συνέπειες της νόσησης από COVID-19. Οποιεσδήποτε παρενέργειες από τη λήψη του εμβολίου είναι φυσιολογικά σημάδια ότι ο οργανισμός δημιουργεί προστασία".
Ευτυχώς για τον ΠΟΥ και το CDC, έχουν το βολικό μέσο διάσωσης της "συνεχούς και ταχείας εξέλιξης" για να εξηγήσουν τις αντιφάσεις και τις αποτυχίες των εμβολίων που λέγεται ότι βασίζονται σε αυτό το φανταστικό κομμάτι ενός ιδεατού "ιού". Θέλουν να σας κάνουν να πιστέψετε ότι τα εμβόλια δεν θα είναι ποτέ 100% αποτελεσματικά όσο η ακίδα της πρωτεΐνης μπορεί να αλλάζει μαγικά μέσα στο κομπιούτερ... ε, στο σώμα. Έτσι, θα χρειαστούν νεότερα και καλύτερα εμβόλια που δημιουργήθηκαν για την εξελιγμένη ακίδα πρωτεΐνης μαζί με τακτικές ενισχύσεις για να καταπολεμηθεί η ασύλληπτη φύση αυτής της εξαιρετικά ευφυούς πρωτεΐνης που είναι προικισμένη με υπερδυνάμεις αλλαγής σχήματος. Τυχόν αποτυχίες οφείλονται στο εξελισσόμενο σωματίδιο και όχι στην δόλια προσέγγιση.
Προφανώς, υπάρχουν αρκετά προβλήματα με αυτή την ιστορία πέρα από την αδυναμία να παρατηρηθεί η φανταστική διαδικασία παραγωγής της ακίδας πρωτεΐνης να διαδραματίζεται μέσα σε έναν ζωντανό οργανισμό, καθώς και οι φανταστικές εξελικτικές δυνάμεις αυτής της μικροσκοπικής πρωτεΐνης. Αν κάποιος σκεφτεί κριτικά και λογικά, θα θέσει τα ίδια ερωτήματα που θα έπρεπε να θέσει και για τις αποδείξεις της ύπαρξης οποιουδήποτε "ιού".
Πώς ανακαλύφθηκε αυτή η ακίδα πρωτεΐνης;
Έχει παρατηρηθεί ποτέ αυτή η πρωτεΐνη στη φύση;
Καθαρίστηκε και απομονώθηκε απευθείας από τα υγρά άρρωστων ανθρώπων ή ήταν δημιούργημα της διαδικασίας καλλιέργειας κυττάρων;
Πώς προσδιορίστηκε η λειτουργία της;
Πραγματοποιήθηκαν κατάλληλοι έλεγχοι σε οποιαδήποτε από τις μελέτες;
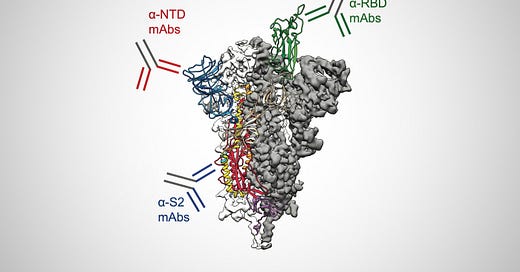
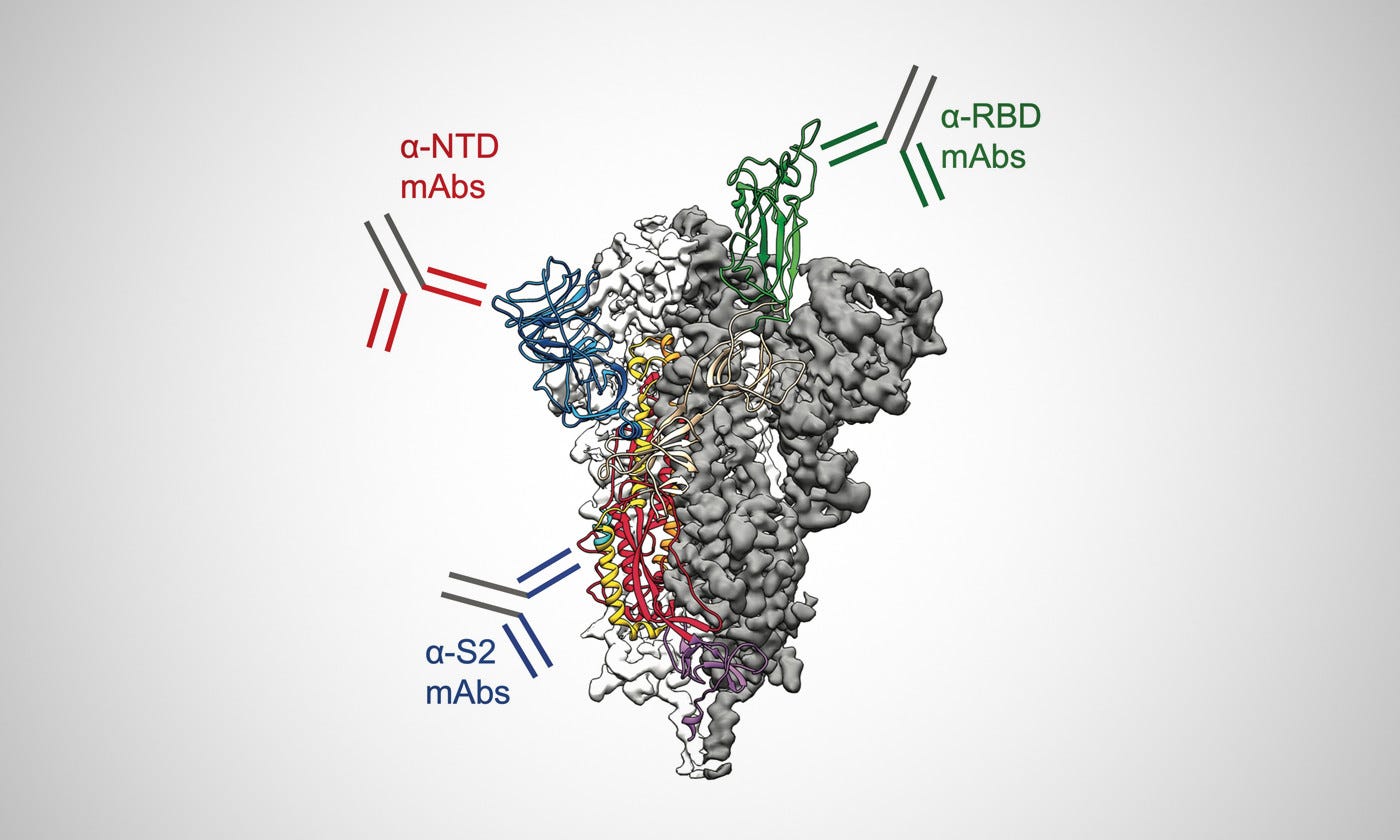
Θα πρέπει να είναι σαφές σε όποιον έχει εξετάσει ποτέ τα πρωτότυπα έγγραφα που παρέχονται ως αποδεικτικά στοιχεία για τους "κορονοϊούς" ότι η ακίδα της πρωτεΐνης δεν είναι παρά ένα δημιούργημα βασισμένο στα σχέδια χρώσης τυχαίων σωματιδίων που επιλέγονται ως αναπαράσταση του υποτιθέμενου "ιού". Μερικές φορές αυτές οι αιχμές εμφανίζονται στις εικόνες του ηλεκτρονικού μικροσκοπίου και άλλες φορές όχι (παρόλο που λέγεται ότι υπάρχουν):
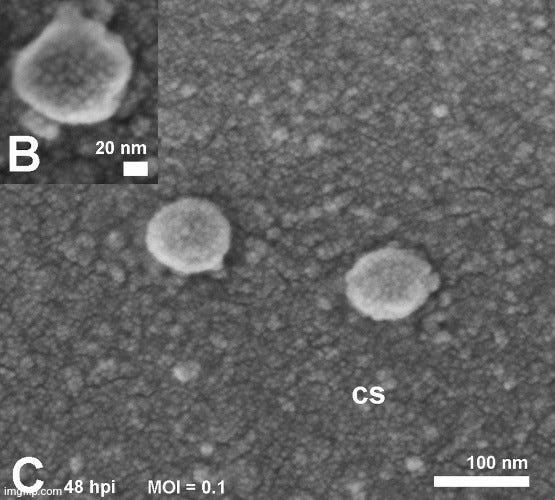
Διακρίσιμες αιχμές;! "Οι αιχμές των σωματιδίων SARS-CoV-2 που παρατηρήθηκαν στην επιφάνεια των κυττάρων ήταν διακριτές" https://www.nature.com/articles/s41598-020-73162-5/figures/2
Εάν οι αιχμές δεν παρατηρούνται, μερικές φορές το δείγμα χειραγωγείται μέχρι να εμφανιστούν, όπως έγινε σε αυτή την πρόσφατη μελέτη "SARS-COV-2" από την Αυστραλία, όπου προστέθηκε τρυψίνη, ένας πρωτεϊνικός χωνευτής, για να αλλάξει η εμφάνιση των απεικονιζόμενων σωματιδίων ώστε να περιέχουν τις αιχμές:
"Οι ηλεκτρονικές μικρογραφίες του αρνητικά χρωματισμένου υπερκείμενου υγρού έδειξαν σφαιρικά και πλειομορφικά σωματίδια που μοιάζουν με ιούς διαμέτρου 90-110 nm- τα σωματίδια εμφάνιζαν εμφανείς αιχμές (9-12 nm), χαρακτηριστικές των ιών της οικογένειας Coronaviridae (Πλαίσιο 5, Α). Ηλεκτρονικές μικρογραφίες τομών κυττάρων VERO/hSLAM έδειξαν κυτταροπλασματικά κυστίδια συνδεδεμένα με μεμβράνη που περιείχαν σωματίδια κοροναϊού (Πλαίσιο 5, Β) Μετά από αρκετές αποτυχίες ανάκτησης ιόντων με το χαρακτηριστικό περιθώριο των επιφανειακών πρωτεϊνών ακίδων, διαπιστώθηκε ότι η προσθήκη θρυψίνης στο μέσο κυτταροκαλλιέργειας βελτίωσε αμέσως τη μορφολογία των ιόντων".
Ένα πράγμα που είναι σίγουρο στην περίπτωση της δημιουργίας αυτών των spikeed πρωτεϊνών είναι ότι τα σωματίδια που παρατηρούνται δεν προέρχονται από καθαρισμένους και απομονωμένους "ιούς" που βρίσκονται απευθείας στα υγρά των άρρωστων οργανισμών. Στην πραγματικότητα, δεν είναι καν ειδικά για τους "κορονοϊούς" καθόλου, καθώς μπορούν να παρατηρηθούν σε πολλά εξωκυτταρικά κυστίδια, όπως κυστίδια με επικάλυψη κλαθρίνης και εξωσώματα:
Ακόμα και η γρίπη των χοίρων H1N1 του 2009 λαμβάνει λίγη αγάπη με ακίδες:
https://www.sciencephoto.com/media/83724/view/2009-h1n1-swine-flu-virus-tem#
Τα σωματίδια που ισχυρίζονται ότι είναι ακίδες πρωτεϊνών είναι ένα δημιούργημα που προέρχεται από τη διαδικασία κυτταροκαλλιέργειας που χρησιμοποιήθηκε για την "απομόνωση" των "ιών" καθώς και από τις προετοιμασίες που έγιναν προκειμένου να ληφθούν οι εικόνες μέσω ηλεκτρονικής μικροσκοπίας. Όπως είπε ο Harold Hillman, οι εικόνες που λαμβάνονται στο τέλος της διαδικασίας απέχουν πολύ από την πραγματικότητα:
"Για παράδειγμα, οι περισσότεροι κυτταρολόγοι γνωρίζουν, αλλά οι αναγνώστες των στοιχειωδών εγχειριδίων όχι, ότι όταν κάποιος κοιτάζει μια απεικόνιση μιας ηλεκτρονικής μικρογραφίας: ένα ζώο έχει θανατωθεί- ψύχεται- ο ιστός του αφαιρείται- ο ιστός σταθεροποιείται (θανατώνεται)- χρωματίζεται με ένα άλας βαρέων μετάλλων- αφυδατώνεται με αυξανόμενες συγκεντρώσεις αλκοόλης- συρρικνώνεται- η αλκοόλη εξάγεται με έναν λιπαρό διαλύτη, το οξείδιο του προπυλενίου- το τελευταίο αντικαθίσταται από μια εποξειδική ρητίνη- σκληραίνει σε λίγες ημέρες- κόβονται τομές πάχους ενός δεκάτου του χιλιοστού ή και λιγότερο, τοποθετούνται στο ηλεκτρονικό μικροσκόπιο, από το οποίο εξάγεται σχεδόν όλος ο αέρας- μια δέσμη ηλεκτρονίων στα 10.000 βολτ έως 3.000.000 βολτ κατευθύνεται προς αυτό- μερικά ηλεκτρόνια προσκρούουν σε μια φωσφορίζουσα οθόνη- οι χειριστές των ηλεκτρονικών μικροσκοπίων επιλέγουν το πεδίο και τη μεγέθυνση που δείχνουν τα χαρακτηριστικά που επιθυμούν να επιδείξουν- η εικόνα μπορεί να βελτιωθεί- λαμβάνονται φωτογραφίες- ορισμένες επιλέγονται ως αποδεικτικά στοιχεία. Μπορεί κανείς να δει αμέσως πόσο μακριά έχει ταξιδέψει ο ιστός από τη ζωή σε μια απεικόνιση σε ένα βιβλίο".
https://www.big-lies.org/harold-hillman-biology/what-price-intellectual-honesty.htm
Θα πρέπει να είναι σαφές ότι αν κανένας από τους "κορονοϊούς" (που κυμαίνονται σε μέγεθος από 60 έως 150 nm) δεν έχει ποτέ καθαριστεί, απομονωθεί και διαχωριστεί σωστά από οτιδήποτε άλλο προκειμένου να μελετηθεί ανεξάρτητα, οι πολύ μικρότερες επιφανειακές αιχμές του "ιού" (που κυμαίνονται από 9 έως 12 nm) δεν έχουν επίσης ποτέ καθαριστεί και απομονωθεί σωστά προκειμένου να μελετηθούν ανεξάρτητα. Για να το επιβεβαιώσω αυτό, έψαξα λίγο τις λεγόμενες διαδικασίες καθαρισμού και απομόνωσης που σχετίζονται με την ίδια την αιχμή. Έπεσα πάνω σε ένα βιβλίο του David Cavanagh, ενός ανθρώπου στενά συνδεδεμένου με τη μελέτη αυτής της πρωτεΐνης. Ασχολήθηκε με την έρευνα του "ιού της λοιμώδους βρογχίτιδας (IBV) του κορονοϊού", εστιάζοντας στην ταυτοποίηση και τον μοριακό χαρακτηρισμό των πρωτεϊνών του "ιού". Στο βιβλίο του, έθεσε τα θεμελιώδη έγγραφα για τον υποτιθέμενο καθαρισμό και την απομόνωσή του:
--> Η επιφάνεια του κορονοϊού, Γλυκοπρωτεΐνη
A. Παρατηρήσεις στο ηλεκτρονικό μικροσκόπιο
"Συχνά υποστηρίζεται ότι οι κορονοϊοί έχουν χαρακτηριστική μορφολογία, συμπεριλαμβανομένης της κατοχής μιας επιφανειακής προεξοχής σε σχήμα "ρόπαλου" ή γλυκοπρωτεΐνης αιχμής (S). Ωστόσο, από κοινού με άλλες πτυχές των κορονοϊών, η ομάδα παρουσιάζει παραλλαγές όσον αφορά το σχήμα, το μέγεθος και την κατανομή της πρωτεΐνης S στην επιφάνεια του ιού. Οι Davies και Macnaughton (1979) περιέγραψαν τις αιχμές του ιού της λοιμώδους βρογχίτιδας (IBV) και του ανθρώπινου κοροναϊού (HCV) 229E ως "δακρυγόνα" και ευρέως διατεταγμένες, ενώ εκείνες του ιού της ηπατίτιδας του ποντικού (MHV) τύπου 3 ήταν κυρίως "κωνικού σχήματος" και στενά διατεταγμένες, αν και σε ορισμένα παρασκευάσματα του MHV-3 οι αιχμές ήταν πιο βολβοειδείς. Οι διαστάσεις των S ποικίλλουν όχι μόνο μεταξύ των κορονοϊών αλλά και ανάλογα με τη διαδικασία χρώσης- μετά από χρώση με φωσφοτουγγικό κάλιο και οι τρεις ιοί είχαν αιχμές μήκους περίπου 20 nm και πλάτους 10 nm στο βολβοειδές άκρο, εκτός από τις κωνικού σχήματος αιχμές του MHV, οι οποίες είχαν διάμετρο μόνο 5 nm (Davies and Macnaughton, 1979). Ολόκληρη η πρωτεΐνη S έχει παρατηρηθεί μετά από διαλυτοποίηση και καθαρισμό (Sturman et 01., 1980- Cavanagh, 1983c). Η υπομονάδα SI της πρωτεΐνης S του IBV που δεν συνδέεται με τον φάκελο μπορεί να αποκολληθεί από το ιό (Stern and Sefton, 1982a, Cavanagh and Davis, 1986).
B. Χαρακτηριστικά καθίζησης
Ο καθαρισμός της πρωτεΐνης S του MHV, του IBV, του στελέχους 229E του HCV, του κοροναϊού των βοοειδών (BCV) και του ιού της εγκεφαλομυελίτιδας των χοίρων (HEV) έχει επιτευχθεί με συνδυασμό μη ιοντικού απορρυπαντικού και φυγοκέντρησης με διαβάθμιση σακχαρόζης (Sturman et a1., 1980- Hasony and Macnaughton, 1981- Cavanagh, 1983b- Schultze et a1., 1990, 1991). Όταν χρησιμοποιήθηκαν ποσότητες IBV σε χιλιοστόγραμμα, ήταν απαραίτητο να διαχωριστούν και να καθιζάνουν οι πρωτεΐνες του ιού παρουσία 1 Μ NaCI- διαφορετικά η πρωτεΐνη Μ καθιζάνει με την S (Cavanagh, 1983b). Η ακίδα (Spike) έχει επίσης καθαριστεί µε χρωµατογραφία συγγένειας (Mockett, 1985- Daniel and Talbot, 1990). Οι μελέτες καθίζησης έχουν ερμηνευθεί ποικιλοτρόπως ως ένδειξη ότι η S από τα ιώματα είναι ομοδιμερές ή ομοτριμερές (IBV: Cavanagh, 1983eL ομοδιμερές (MHV: Vennema et a1., 1990b), ή ομοτριμερές (TGEV: Delmas and Laude, 1990)".
Κάντε κλικ για πρόσβαση στο 10.1007%2F978-1-4899-1531-3_5.pdf
Δεν είναι στις προθέσεις μου να αποδομήσω πλήρως κάθε ένα από τα έγγραφα καθαρισμού/απομόνωσης που παρατίθενται, καθώς φαίνεται μάλλον γελοίο να το κάνω, όταν οι "ιοί" από τους οποίους υποτίθεται ότι προέρχονται αυτές οι πρωτεΐνες αιχμής δεν έχουν ποτέ αποδειχθεί επιστημονικά ότι υπάρχουν. Ωστόσο, θέλω να μοιραστώ μερικά σύντομα σημεία από κάθε εργασία, ώστε να είναι απολύτως σαφές το μέγεθος των χειρισμών και των αλλαγών που πρέπει να υποστεί το δείγμα προκειμένου να ληφθούν τα επιθυμητά αποτελέσματα. Αυτές οι "πρωτεΐνες" προέρχονται από τη διαδικασία της μη καθαρισμένης κυτταρικής καλλιέργειας, όπου προστίθενται πολλές ουσίες και δεν απομονώνεται τίποτα. Θα είναι σαφές να δούμε πόσο μακριά από την πραγματικότητα έχει ταξιδέψει το δείγμα προκειμένου να γίνει μια εικόνα που δημοσιεύεται σε μια μελέτη. Είναι πέρα από κάθε φαντασία να υποθέσουμε ότι τα αντιπροσωπευτικά σωματίδια, που απεικονίζονται σε μια έντονα τροποποιημένη νεκρή και σταθεροποιημένη κατάσταση, έχουν οποιαδήποτε σχέση με τις πραγματικές βιολογικές διαδικασίες. Δεν είναι παρά ένα δημιούργημα από τις πολυάριθμες διαδικασίες που χρησιμοποιήθηκαν προκειμένου να προκύψουν τα τελικά αποτελέσματα.
---> 1980
Πρώτη είναι η αρχική εργασία καθαρισμού και απομόνωσης των ακίδων πρωτεϊνών που παρουσιάζεται ως αποδεικτικό στοιχείο από τον Cavanagh. Τόνισα το πλήρες τμήμα των μεθόδων αυτής της μελέτης προκειμένου να παρουσιάσω τα πολυάριθμα βήματα που απαιτούνται για να φτάσουμε στο τελικό αποτέλεσμα. Πολλά από τα επόμενα έγγραφα ακολουθούν παρόμοιες διαδικασίες για να δημιουργήσουν τα αποτελέσματά τους, οπότε μη διστάσετε να ψάξετε το καθένα για πιο λεπτομερείς περιγραφές των ψευδοεπιστημονικών διαδικασιών που χρησιμοποιούνται.
Αυτό που θα δείτε σε αυτό το έγγραφο είναι ότι ο "ιός" είναι μια δημιουργία κυτταρικής καλλιέργειας που συμπληρώνεται με το συνηθισμένο μέσο μαζί με εμβρυϊκό ορό βοοειδών και αντιβιοτικά. Ο ίδιος ο εμβρυϊκός ορός βοοειδών αποτελεί πηγή ξένου γενετικού υλικού μαζί με άλλες ουσίες και ενώσεις. Η κυτταρική σειρά που χρησιμοποιήθηκε ήταν η κυτταρική σειρά ινοβλαστών ποντικού 17Cl-1, η οποία, σύμφωνα με το BEI Resources, "προήλθε από αυθόρμητο μετασχηματισμό κυττάρων 3T3. Το 3T3 είναι μια μη ογκογόνος κυτταρική σειρά που δημιουργήθηκε από έμβρυα ηλικίας 14 έως 17 ημερών του στελέχους Balb/c ποντικών. Τα κύτταρα 17Cl-1 χρησιμοποιούνται για την καλλιέργεια κορονοϊών ποντικού, συμπεριλαμβανομένου του ιού της ηπατίτιδας του ποντικού". Έτσι, μπορούμε να δούμε ότι πρόκειται ήδη για ένα μη καθαρισμένο παρασκεύασμα.
Αφού καλλιεργήθηκε ο "ιός", "συλλέχθηκε" από το δείγμα προτού εμφανιστούν σημαντικές ποσότητες κυτταροπαθητικών αλλαγών, όπως η σύντηξη ή η λύση των κυττάρων (τα ίδια κριτήρια που χρησιμοποιούνται για να διαπιστωθεί ότι υπάρχει "ιός") και στη συνέχεια φυγοκεντρήθηκε. Το δείγμα καταβυθίστηκε με την προσθήκη 5,0 g NaCl ανά 150 ml διαυγασμένου υπερκείμενου υγρού και στη συνέχεια μισού όγκου 30% πολυαιθυλενογλυκόλης. Ο "ιός" υποβλήθηκε στη συνέχεια σε μια σειρά από στάδια φυγοκέντρησης με διάφορες χημικές ουσίες και τελικά ραδιοσημάνθηκε με μίγμα ουριδίνης και αμινοξέων. Προστέθηκε NP40 για τη διάσπαση των "ιόντων". Σύμφωνα με τον εν λόγω κατασκευαστή, το NP40 είναι ένα "μη ιοντικό επιφανειοδραστικό χρήσιμο για την απομόνωση και τον καθαρισμό λειτουργικών συμπλεγμάτων πρωτεϊνών μεμβράνης. Αυτό το απορρυπαντικό έχει καθαριστεί για να μειώσει τα επίπεδα των αλδεϋδών, των μετάλλων, των υπεροξειδίων και των αλάτων που προκαλούν μόλυνση". Με άλλα λόγια, προστέθηκαν περισσότερες μολυσματικές/ξένες ουσίες για να "καθαριστούν/ιδολωθούν" οι πρωτεΐνες.
Στη συνέχεια, το δείγμα υποβλήθηκε στις συνήθεις διαδικασίες προετοιμασίας της ηλεκτρονικής μικροσκοπίας. Το δείγμα υποβλήθηκε επίσης σε ηλεκτροφόρηση σε πηκτή με ένα σωρό πρόσθετες χημικές ουσίες επεξεργασίας-μείγματος και στη συνέχεια φορτίστηκε υπό υψηλή τάση για 4 ώρες προκειμένου να διαχωριστούν οι πρωτεΐνες. Τελικά, οι ερευνητές χρησιμοποίησαν θεωρητικά αντισώματα που δημιουργήθηκαν με παρόμοιους μη καθαρισμένους τρόπους για να επισημάνουν και να ισχυριστούν ότι τα σωματίδια που παρατηρήθηκαν ήταν αυτά που είχαν προστεθεί και τα οποία αναζητούσαν. Όπως συμβαίνει συνήθως, στη μελέτη αυτή δεν περιγράφηκαν κατάλληλοι έλεγχοι:
---> Απομόνωση των γλυκοπρωτεϊνών του φακέλου του κορονοϊού και αλληλεπίδραση με το πυρηνοκαψίδιο του ιού
"Μελέτες των πολυπεπτιδίων του ιού πολλών διαφορετικών κορονοϊών σε διάφορα εργαστήρια οδήγησαν σε αναφορές για τρία έως δώδεκα ή περισσότερα είδη πολυπεπτιδίων που συνδέονται με τους ιούς (1, 3, 7, 11, 16, 19, 23, 24, 28-31, 33,35, 44, 45, 48- 0. W. Schmidt and G. E. Kenny, Fed. Proc. 38:910, 1979). Οι λόγοι για την προφανή ποικιλοµορφία στα πολυπεπτιδικά πρότυπα των κορονοϊών δεν είναι πλήρως κατανοητοί. Οι διαφορές στην τεχνική και η ατελής διάκριση των πολυπεπτιδίων του ιού από εκείνα που προέρχονται από τον ξενιστή μπορεί να ευθύνονται για ορισμένες από τις διαφορές. Ωστόσο, ακόµη και όταν χρησιµοποιούνται τα ίδια συστήµατα πηκτής και οι ίδιες συνθήκες στο ίδιο εργαστήριο, έχουν παρατηρηθεί σηµαντικές διαφορές στον αριθµό και το µέγεθος των πολυπεπτιδίων των ιόντων διαφορετικών στελεχών κοροναϊών (30). Προτείνουμε ότι μέρος αυτής της φαινομενικής ανομοιότητας στα πρότυπα πολυπεπτιδίων των κορονοϊών μπορεί να είναι αποτέλεσμα ασυνήθιστων χαρακτηριστικών των γλυκοπρωτεϊνών του φακέλου τους".
- ΥΛΙΚΑ ΚΑΙ ΜΕΘΟΔΟΙ
"Κύτταρα και ιός. Ένα αυθόρμητα μετασχηματισμένο παράγωγο της κυτταρικής σειράς BALB/c 3T3, με την ονομασία 17 Cl 1, και το παράγωγο L2 της κυτταρικής σειράς L929 αναπτύχθηκαν σε μέσο Dulbecco συμπληρωμένο με 10% μη θερμαινόμενο εμβρυϊκό ορό βοοειδών, πενικιλλίνη (100 U/ml) και στρεπτομυκίνη (100 ,ug/ml). Το στέλεχος A59. του ιού της ηπατίτιδας ποντικού παράχθηκε σε κύτταρα 17 Cl 1 και εξετάστηκε με τιτλοδότηση πλακών σε κύτταρα L2, όπως περιγράφηκε προηγουμένως (46).
Παραγωγή και καθαρισμός του ιού. Μονοστρώματα κυττάρων 17 Cl 1 σε γυάλινες κυλινδρικές φιάλες (120 x 260 mm, επιφάνεια κυττάρων 690 cm2 ) εμβολιάστηκαν με τον ιό A59 σε πολλαπλότητα 1 έως 10 PFU/κύτταρο. Μετά από περίοδο προσρόφησης 1 ώρας στους 37°C, προστέθηκαν σε κάθε κυλινδρική φιάλη 50 ml ελάχιστου απαραίτητου μέσου Eagle με 10% μη θερμαινόμενο εμβρυϊκό ορό βοοειδών. Τα κύτταρα επωάστηκαν στους 37°C.
Ο απελευθερούμενος ιός συλλέχθηκε συνήθως 24 έως 26 ώρες μετά τον εμβολιασμό, μετά από αρκετούς κύκλους μόλυνσης, όταν επιτυγχάνονταν υψηλές αποδόσεις και πολύ πριν από την εμφάνιση σημαντικών ποσοτήτων κυτταροπαθητικών αλλαγών, όπως σύντηξη ή λύση κυττάρων. Ο απελευθερωμένος ιός φυγοκεντρήθηκε σε 10.000 x g (μέσος όρος) σε ρότορα Sorvall GSA για 30 λεπτά στους 4°C για την απομάκρυνση των υπολειμμάτων. Για τη βέλτιστη διατήρηση της μολυσματικότητας του ιού, ο φρεσκοσυλλεγμένος ιός καθαρίστηκε αμέσως στους 4°C χωρίς κατάψυξη ή αποθήκευση.
Ο ιός καταβυθίστηκε με την προσθήκη 5,0 g NaCl ανά 150 ml διαυγασμένου υπερκείμενου υγρού και στη συνέχεια μισού όγκου 30% πολυαιθυλενογλυκόλης, ώστε να προκύψει τελική συγκέντρωση 10% πολυαιθυλενογλυκόλης και 2,2% NaCl. Το ίζημα συλλέχθηκε με φυγοκέντρηση στα 10.000 x g (μέσος όρος) για 30 λεπτά στους 4°C, επαναιωρήθηκε σε ρυθμιστικό διάλυμα TMEN 6 (5 ml/3 κυλινδρικές φιάλες αρχικού ιού) που περιείχε 0,05 M Tris-maleate-0,001 M EDTA-0,1 ml NaCl (pH 6. 0) στους 4°C, και διαστρώθηκε πάνω σε μια ασυνεχή κλίση 4 ml από κάθε ένα από τα 30 και 50% (κ.β./κ.β.) σακχαρόζη σε ρυθμιστικό διάλυμα TMEN 6 σε σωλήνα φυγοκέντρησης 17,5 ml ή 3 ml 30% και 2 ml 50% (κ.β./κ.β.) σακχαρόζη σε TMEN 6 σε σωλήνα φυγοκέντρησης 12,5 ml. Μετά από φυγοκέντρηση για 4 ώρες στις 25.000 στροφές ανά λεπτό σε στροφείο Spinco SW 27.1 (82.000 x g, μέσος όρος) ή 3 ώρες στις 30.000 στροφές ανά λεπτό σε στροφείο Spinco SW 41 (110.000 x g, μέσος όρος) στους 4°C, η στενή λευκή ζώνη ιού στη διεπιφάνεια μεταξύ 30 και 50% σακχαρόζης συλλέχθηκε, αραιώθηκε 2,5 φορές με ρυθμιστικό διάλυμα TMEN 6 και τοποθετήθηκε πάνω σε συνεχή διαβάθμιση 7,5 ή 12 ml από 20 έως 50% σακχαρόζη σε ρυθμιστικό διάλυμα TMEN 6. Αυτή η κλίση φυγοκεντρήθηκε για 18 ώρες στις 25.000 στροφές ανά λεπτό (82.000 x g, μέσος όρος) στους 4°C σε ρότορα Spinco SW 27.1 ή στις 30.000 στροφές ανά λεπτό σε ρότορα Spinco SW 41 (110.000 x g, μέσος όρος) και συλλέχθηκε η ζώνη ιού στα 1,17 έως 1,19 g/ml. Στη συνέχεια, ο ιός αραιώθηκε με ρυθμιστικό διάλυμα TMEN 6 και είτε χρησιμοποιήθηκε απευθείας, είτε σφαιροποιήθηκε σε ρότορα SW 50.1 Spinco, είτε διαλύθηκε έναντι ρυθμιστικού διαλύματος ή νερού. Τα δεδομένα από έναν αντιπροσωπευτικό καθαρισμό του ιού (Πίνακας 2) δείχνουν μείωση του όγκου κατά 50 έως 100 φορές και μεγαλύτερη από 100 φορές μείωση της συνολικής πρωτεΐνης, με 60 έως 100% ανάκτηση της μολυσματικότητας του ιού. Η τελική ειδική μολυσματικότητα που επιτεύχθηκε ήταν 5 x 10'0 έως 10 x 1010 PFU/ml πρωτεΐνης.
Ως πρακτική ρουτίνας, καθαρίζονταν ταυτόχρονα έως και 900 ml ιού. Αυτός είναι ο όγκος που λαμβάνεται από 18 φιάλες κυλίνδρων με μολυσμένα κύτταρα. Ο ιός που συλλέχθηκε στις 24 ώρες είχε τίτλο 2 x 10^8 έως 5 x 10^8 PFU/rnl και στις 42 έως 48 ώρες ο τίτλος ήταν 0,5 x 10^9 έως 2 x 10^9 PFU/ml. Έτσι, ανάλογα με τον χρόνο συγκομιδής, οι αποδόσεις του απελευθερωμένου ιού ήταν 10^10 έως 10^11 PFU/μπουκάλι κύλινδρου.
Ραδιοσήμανση του ιού. Στο μέσο προστέθηκαν ραδιοσημασμένες ενώσεις σε τελική συγκέντρωση 2 έως 4 uCi μίγματος L-3H-αμινοξέων ή [5-3H]ουριδίνης ανά ml, 3 uCi [6-3H]φουκόζης ανά ml και 1 έως 4 uCi [35S]μεθειονίνης ανά ml. Οι μολυσμένες καλλιέργειες επωάστηκαν παρουσία αυτών των ενώσεων από περίπου 1 ώρα μετά τον εμβολιασμό του ιού έως τη συγκομιδή του ιού. Η επισημασμένη ουριδίνη και το μείγμα αμινοξέων αγοράστηκαν από την New England Nuclear Corp., Βοστώνη- η επισημασμένη μεθειονίνη και η φουκόζη ελήφθησαν από την Amersham Corp., Arlington Heights, Ill [Το επισημασμένο με 3H]-ουριδίνη 28S rRNA κυττάρων HeLa παραχωρήθηκε ευγενικά από τον N. K. Chatterjee.
Διαταραχή των ιόντων με NP40. Τα καθαρισμένα ιόντα από τρεις ή λιγότερες φιάλες κυλίνδρων συνήθως σφαιροποιήθηκαν και επαναιωρήθηκαν σε 1 έως 2 ml ρυθμιστικού διαλύματος TMEN 6 στους 4°C. Προστέθηκε NP40, το οποίο παραχωρήθηκε ευγενικά από την Shell, Inc. σε τελική συγκέντρωση 0,25 έως 1% και το μείγμα ανακινήθηκε έντονα με το χέρι τουλάχιστον 20 φορές. Σε ορισμένα πειράματα ένα μέρος του ιού που είχε υποστεί επεξεργασία με απορρυπαντικό επωάστηκε στους 37°C για 30 λεπτά σε αυτό το στάδιο. Οι επεξεργασμένοι με απορρυπαντικό ιοί στρωματοποιήθηκαν στη συνέχεια στους 4°C πάνω σε βαθμίδες σακχαρόζης 15 έως 50% σε ρυθμιστικό διάλυμα TMEN 6 που περιέχει 0,1% NP40 ή στους 10°C πάνω σε βαθμίδες σακχαρόζης 30 έως 75% σε ρυθμιστικό διάλυμα TMEN 6 που περιέχει 0,1% NP40. Ένα μαξιλάρι από 76% Renografin ή 65 έως 75% σακχαρόζη τοποθετήθηκε κάτω από την κλίση 15 έως 50% σακχαρόζης. Εκτός εάν αναφέρεται διαφορετικά, οι κλίσεις καταβυθίστηκαν σε 38.000 στροφές ανά λεπτό (180.000 x g, κατά μέσο όρο) για 16 έως 20 ώρες σε ρότορα SW 41 στους 4 ή 10°C. Τα κλάσματα της διαβάθμισης συλλέγονταν από την κορυφή της διαβάθμισης με συσκευή κλασματοποίησης ISCO ή από τον πυθμένα με εκτόπιση με ελαφρύ παραφινέλαιο που παραδιδόταν με σύριγγα Cornwall. Τα κλάσματα βαθμίδας συλλέχθηκαν σε ψυχόμενους σωλήνες και διατηρήθηκαν στους 4°C. Τα δείγματα για τη ραδιοϊσοτοπική καταμέτρηση προετοιμάστηκαν με τη μεταφορά τμημάτων 50 έως 450 pd από κάθε κλάσμα βαθμίδας σε 1 ml νερού-10 ml Aquasol (New England Nuclear). Οι δείκτες διάθλασης των κλασμάτων διαβάθμισης προσδιορίστηκαν με διαθλασίμετρο Abbe της Bausch and Lomb. Για τη διάσπαση των νουκλεοκαψιδικών συμπλόκων χρησιμοποιήθηκαν συνεχείς κλίσεις 20-50% Renografin-76 (E. R. Squibb & Sons, Princeton, N.J.) που περιείχαν 0,1% NP40. Η καθίζηση πραγματοποιήθηκε σε 25.000 rpm (82.000 x g, κατά μέσο όρο) για 16 ώρες σε ρότορα SW 27.1 στους 4°C.
Ηλεκτρονική μικροσκοπία. Δείγματα καθαρισμένων γλυκοπρωτεϊνικών παρασκευασμάτων τοποθετήθηκαν σε χάλκινα πλέγματα χαλκού καλυμμένα με άνθρακα Formvar 400 ματιών, χρωματίστηκαν αρνητικά με 2% φωσφοτουγγικό οξύ σε pH 7,2 και εξετάστηκαν με ηλεκτρονικό μικροσκόπιο διέλευσης Philips 400.
Ηλεκτροφόρηση σε πηκτή SDS-πολυακρυλαμιδίου. Η μέθοδος ηλεκτροφόρησης πηκτής SDS-πολυακρυλαμιδίου με ασυνεχές ρυθμιστικό διάλυμα υψηλού pH σε κυλινδρικές πηκτές που χρησιμοποιήθηκε στην παρούσα μελέτη έχει περιγραφεί προηγουμένως (44). Επειδή το πολυπεπτίδιο El συσσωματώνεται μετά από βρασμό με SDS παρουσία μερκαπτοαιθανόλης (44), τα δείγματα ιικών πολυπεπτιδίων για την παρούσα μελέτη προετοιμάστηκαν για ηλεκτροφόρηση με θέρμανση στους 37°C για 30 λεπτά απουσία μερκαπτοαιθανόλης. Οι πηκτές πλάκας με διαβάθμιση πολυακρυλαμιδίου πέντε έως είκοσι τοις εκατό πάχους 1,5 mm και μήκους 10 cm παρασκευάστηκαν με τη μέθοδο Laemmli σε συσκευή ηλεκτροφόρησης με πηκτή πλάκας Hoeffer. Κάθε φρεάτιο φορτώθηκε με περίπου 40 ul ραδιοσημασμένου δείγματος το οποίο είχε θερμανθεί στους 37°C για 15 λεπτά με ίσο όγκο μίγματος επεξεργασίας δείγματος αποτελούμενο από 6 M ουρία, 4% SDS, 0,05% μπλε της βρωμοφαινόλης σε 0,0625 M Tris-chloride, pH 6,7. Οι πηκτές εκτελέστηκαν στα 125 V για περίπου 4 ώρες υπό σταθερή τάση από τροφοδοτικό Savant. Οι πηκτές εμποτίστηκαν με PPO (2,5-διφαινυλοξαζόλη, Sigma) σε διμεθυλοσουλφοξείδιο με τη μέθοδο των Bonner και Laskey (4), ξηράνθηκαν με ξηραντήρα πηκτής Savant σε χαρτί χρωματογραφίας Whatman αριθ. 17, εκτέθηκαν σε φιλμ Kodak XR-5 στους -70°C για 1 έως 4 εβδομάδες και αναπτύχθηκαν με χημικά της Kodak X-ray.
Προετοιμασία αντιορών. Ο αντιορός που κατευθύνεται κατά των πολυπεπτιδίων του ιού A59 παρασκευάστηκε με καθαρισμό του απελευθερωμένου ιού μέσω ασυνεχούς και συνεχούς βαθμίδας σακχαρόζης όπως περιγράφεται ανωτέρω, χωρίς προηγούμενη καθίζηση με PEG. Ο καθαρισμένος, συμπυκνωμένος ιός A59 διασπάστηκε με 1% NP40 και καταψύχθηκε στους -75°C σε aliquots. Μια ποσότητα 0,1 ml του παρασκευάσματος του ιού εμβολιάστηκε με πλήρες βοηθητικό Freund σε ποδοπέδες κουνελιών, ακολουθούμενη μετά από 2 εβδομάδες με μια δεύτερη έγχυση σε ποδοπέδες επιπλέον 0,1 ml με ατελές βοηθητικό Freund (Difco) και 1 εβδομάδα αργότερα με ενδοφλέβια έγχυση άλλων 0,4 ml ιού επεξεργασμένου με απορρυπαντικό. Μετά την τρίτη ένεση, τα κουνέλια αιμορραγούσαν από το αυτί ανά διαστήματα 1 εβδομάδας για 1 μήνα. Το αντίσωμα αυτό ανοσοκατακρήμνισε ειδικά ραδιοσημασμένα El, N και E2 και όχι κυτταρικά πολυπεπτίδια από εκχυλίσματα NP40 μολυσμένων κυττάρων 17 Cl 1.
Οι αντιοροί έναντι των απομονωμένων πρωτεϊνών El και E2 παρασκευάστηκαν με παρόμοιο πρόγραμμα εμβολιασμών κουνελιών από El που προέκυψαν από καθίζηση σε βαθμίδα σακχαρόζης ιόντων A59 που διασπάστηκαν με NP40 στους 4°C και από E2 από ιό που διασπάστηκε με NP40 και είχε επωαστεί στους 37°C πριν από την καθίζηση σε βαθμίδα σακχαρόζης. Οι αντιοροί αυτοί πέρασαν ο καθένας από ανοσορροφητικές στήλες Affigel 10 φορτισμένες με την άλλη ιική γλυκοπρωτεΐνη. Η ειδικότητα των αντιορών προσδιορίστηκε με ανοσοκατακρήμνιση ραδιοσημασμένων ιικών πολυπεπτιδίων από εκχυλίσματα NP40 από μολυσμένα με A59 κύτταρα.
Ανοσοκατακρήμνιση ιϊκών πολυπεπτιδίων.
Ανοσοκατακρημνίσματα ραδιοσημασμένων ιϊκών πολυπεπτιδίων από εκχυλίσματα μολυσμένων κυττάρων, καθαρισμένων ιόντων ή βαθμιδωτά καθαρισμένων El ή E2 έγιναν με τη μέθοδο του Kessler (26). Ποσότητα 25 ul ορού κουνελιού επωάστηκε με 25 έως 200 ul ραδιοσημασμένου δείγματος σε ρυθμισμένο με φωσφορικά άλατα φυσιολογικό ορό που περιείχε 0,1% NP40 στους 0°C για 1 ώρα. Τα σύμπλοκα αντιγόνου-αντισώματος και το αντίσωμα κατακρημνίστηκαν με περίσσεια καθαρισμένων, σταθεροποιημένων σε φορμαλίνη σταφυλόκοκκων (στέλεχος Cowan 1) για 10 λεπτά στους 4°C, σφαιροποιήθηκαν στις 3.000 rpm για 10 λεπτά, πλύθηκαν τρεις φορές σε 1 ml 0,05% NP40 με ρυθμιστικό φυσιολογικό ορό φωσφορικού άλατος και στη συνέχεια διαλύθηκαν στο μείγμα επεξεργασίας του δείγματος με βρασμό για 1 λεπτό ή επεξεργασία στους 37°C για 15-30 λεπτά".
doi: 10.1128/JVI.33.1.449-462.1980
--> 1981
Αυτή η επόμενη μελέτη ακολούθησε παρόμοιες διαδικασίες με την πρώτη. Έχω επισημάνει τις μεθόδους ανάπτυξης του "ιού" και "καθαρισμού" προκειμένου να δείξω ότι αυτός ο ισχυρισμός περί καθαρισμού/απομόνωσης δεν αντέχει σε έλεγχο. Ο "ιός" αναπτύχθηκε σε εμβρυϊκούς ινοβλάστες ποντικού και επωάστηκε σε ελάχιστο απαραίτητο μέσο Eagle με εμβρυϊκό ορό μοσχαριού. Ο "ιός" φυγοκεντρήθηκε και "καθαρίστηκε" με μεθόδους που "συζητήθηκαν προηγουμένως". Οι υπόλοιπες τεχνικές που χρησιμοποιήθηκαν είναι παρόμοιες με εκείνες που αναφέρονται στη μελέτη του 1981 και τα αποτελέσματα βασίζονται σε μεγάλο βαθμό σε ορολογικά δεδομένα, όπου ήταν προφανώς δύσκολο να διασφαλιστούν παρόμοιες αντιδράσεις αντισωμάτων στα ποντίκια που εξετάστηκαν, καθώς παρατηρήθηκε σημαντική διακύμανση. Καμία ΕΜ εικόνα των "καθαρισμένων/απομονωμένων" πρωτεϊνών αιχμής δεν συνοδεύει τη μελέτη:
--> Αντιγονικότητα των υποσυνιστωσών του ιού της ηπατίτιδας του ποντικού στελέχους 3 σε ποντίκια στελέχους C57
-Υλικά και µέθοδοι
-Ανάπτυξη του ιού
"Ο MHV3 καλλιεργήθηκε σε συρρέοντες δευτερογενείς εμβρυϊκούς ινοβλάστες ποντικού. Οι μονόλιθοι μολύνθηκαν με πολλαπλασιασμό εισόδου 0,1 μολυσματικών σωματιδίων ανά κύτταρο και μετά από περίοδο προσρόφησης 1,5 ώρας στους 37°C, επωάστηκαν για 72 ώρες στους 37°C σε MEM Eagle με 2% ορό εμβρύου μοσχαριού (13). Aliquots αυτού του εναιωρήματος του ιού αποθηκεύτηκαν στους -70°C και χρησιμοποιήθηκαν για την παρασκευή καθαρισμένων σωματιδίων και υποσυστατικών του ιού.
- Παρασκευή καθαρισμένου ιού
Ο ιός καθαρίστηκε στους 0° έως 4° C όπως περιγράφηκε προηγουμένως (13). Ο ιός σφαιροποιήθηκε σε 75.000 × g για 1 ώρα και στη συνέχεια επαναιωρήθηκε σε 1 ml ρυθμιστικού φυσιολογικού ορού φωσφορικών αλάτων "Α" του Dulbecco (PBSA). Ο ανασυσταθείς ιός επικαλύφθηκε σε γραμμική διαβάθμιση σακχαρόζης 25 έως 55 % (w/w) σε PBSA και φυγοκεντρήθηκε για 16 ώρες σε 90.000 × g. Συλλέχθηκε η κορυφή του ιού σε 1,18 g/ml".
- Συζήτηση
"Στην παρούσα εργασία αναφέρουμε την απομόνωση και τον καθαρισμό των επιμέρους συστατικών του ιού MHV 3 και δείξαμε τον ρόλο κάθε επιμέρους συστατικού στην προστασία των ανοσοποιημένων ποντικών έναντι της πρόκλησης με μολυσματικό MHV 3. Ήταν δύσκολο να εξασφαλιστεί ότι τα ποντίκια που ανοσοποιήθηκαν με διαφορετικά παρασκευάσματα επιμέρους συστατικών του ιού παρήγαγαν όλα συγκρίσιμες ποσότητες αντισωμάτων, καθώς υπήρχε σημαντική διακύμανση στην ανοσογονικότητα των επιμέρους συστατικών. Οι υψηλότερες αυξήσεις αντισωμάτων που ανιχνεύθηκαν με ELISA στρέφονταν κατά των επιφανειακών προεξοχών, ενώ χαμηλότερες αυξήσεις αντισωμάτων παρατηρήθηκαν κατά της μεμβράνης και του RNP, γεγονός που υποδηλώνει ότι το πιο ανοσογόνο τμήμα του ιού είναι ένα ή περισσότερα αντιγόνα που συνδέονται με τις επιφανειακές προεξοχές. Παρόμοια αποτελέσματα έχουν προκύψει στο παρελθόν με ανθρώπινους εωροϊούς (14) και τον κορονοϊό της μεταδοτικής γαστρεντερίτιδας των χοίρων (TGEV) (5)".
doi: 10.1007/BF01315263.
--> 1983
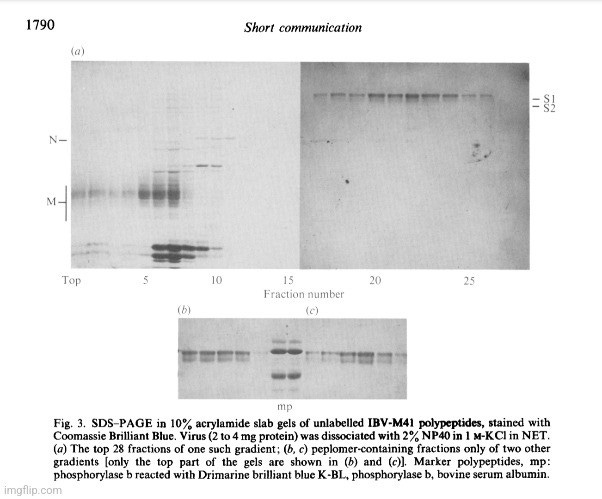
Σε αυτή τη μελέτη, ο "ιός" αναπτύχθηκε στα κύτταρα της χοριοαλλαντικής μεμβράνης (CAM) απο-εμβρυοποιημένων αυγών κοτόπουλου και παρασκευάστηκε ραδιοσημασμένος IBV-M41 σε ζεύγη απο-εμβρυοποιημένων αυγών και υποβλήθηκε σε επεξεργασία. Χρησιμοποιήθηκε η ίδια υπερφυγοκέντρηση του ακάθαρτου καλλιεργημένου υλικού για να ισχυριστεί κανείς την καθαρότητα και την απομόνωση παρόλο που είναι γνωστό ότι η τεχνική αυτή δεν μπορεί να διαχωρίσει σωματίδια του ίδιου μεγέθους, σχήματος και πυκνότητας μεταξύ τους. Στη μελέτη γίνεται δεκτό ότι υπάρχει λιγότερη συμφωνία μεταξύ των ερευνητών σχετικά με τη σύνθεση της πρωτεΐνης S. Παραδέχθηκαν επίσης ότι σε παρασκευάσματα "ιού" ανιχνεύθηκαν και άλλα πολυπεπτίδια των 110Κ και 75Κ, τα οποία υπέθεσαν ότι ήταν πιθανώς πολυπεπτίδια του ξενιστή. Η μελέτη δεν συνοδεύτηκε από εικόνες ΗΜ των καθαρισμένων και απομονωμένων σωματιδίων ούτε έγιναν κατάλληλοι έλεγχοι:
--> Coronavirus IBV: Περαιτέρω αποδείξεις ότι οι επιφανειακές προβολές συσχετίζονται με δύο γλυκοπολυπεπτίδια.
"Το σωματίδιο του ιού της λοιμώδους βρογχίτιδας των πτηνών (IBV), όπως και άλλοι κορονοϊοί, περιέχει τρεις κύριες πρωτεϊνικές δομές, την επιφανειακή προεξοχή ή πεπλομερές (S), το πυρηνοκαψίδιο (N) και τις πρωτεΐνες της μήτρας (M) (Cavanagh, 1981 ; Siddell et al., 1982). Η πρωτεΐνη Μ αποτελείται από ένα πολυπεπτίδιο με mol. wt. 23 000 (23K) το οποίο γλυκοζυλιώνεται σε διαφορετικό βαθμό για να σχηματίσει γλυκοπολυπεπτίδια με mol. wt. έως 36K (Stern et al., 1982; Stern & Sefton, 1982; Cavanagh, 1983). Ένα πολυπεπτίδιο 50Κ έως 54Κ σχηματίζει την πρωτεΐνη Ν (Macnaughton et al., 1977). Υπάρχει λιγότερη συμφωνία σχετικά με τη σύνθεση της πρωτεΐνης S. Δεδομένου ότι τα πιθανά πολυπεπτίδια S όλων των κορονοϊών που εξετάστηκαν έχουν mol. wt. μεγαλύτερο από εκείνο του πολυπεπτιδίου Ν, η ακόλουθη περιγραφή αναφέρεται μόνο σε αυτά τα πολυπεπτίδια του IBV".
"Ο ραδιοσημασμένος IBV-M41 παρασκευάστηκε σε ζεύγη αποεμβρυοποιημένων αυγών (Cavanagh, 1981)- κάθε αυγό έλαβε 125 uCi [35S]μεθειονίνης (sp. act. > 800 Ci/mmol) ή [35S]μεθειονίνης συν 165 uCi μείγματος 15 αμινοξέων σημασμένων με 3Η (κωδικός TRK 440, Amersham International). Ο μη επισημασμένος ιός καλλιεργήθηκε σε παρτίδες 200 εμβρυακών αυγών ηλικίας 11 ημερών, τα οποία εμβολιάστηκαν με περίπου 3-5 log10 μέσης κυλιοστατικής δόσης50 του IBV-M41. Μετά από 24 ώρες στους 37 °C τα αυγά ψύχθηκαν στους 4 °C κατά τη διάρκεια της νύχτας. Συλλέχθηκε το αλλεργικό υγρό, διαυγίστηκε στα 4000 g για 30 λεπτά και ο ιός σφαιροποιήθηκε στα 35000 g για 2-5 ώρες. Το σφαιρίδιο επαναιωρήθηκε σε ρυθμιστικό διάλυμα NET (100 mM- NaC1, 1 mM-EDTA, 10 mM-Tris-HCl pH 7,4) σε όγκο 20 ml και υπερηχογραφήθηκε στο μέγιστο πλάτος για 10 s με τον αισθητήρα 3 mm ενός διαλύτη υπερήχων MSE. Το εναιώρημα τοποθετήθηκε σε δύο ασυνεχείς κλίσεις που περιλάμβαναν 20 m125% (w/w) σακχαρόζη και 5 m160% (w/w) σακχαρόζη σε NET σε περιστρεφόμενο ρότορα 6 x 38 MSE. Μετά από φυγοκέντρηση σε 65.000 gmax για 2,5 ώρες στους 4 °C, οι κλίσεις κλασματοποιήθηκαν. Τα κλάσματα που περιείχαν ιό στην ενδιάμεση φάση 25/60% σακχαρόζης συγκεντρώθηκαν, αραιώθηκαν τριπλά, τοποθετήθηκαν σε διαβάθμιση 25-55% (w/w) σακχαρόζης σε NET και φυγοκεντρήθηκαν σε 50000 gay για 16 ώρες στους 4 °C σε ρότορα 6 x 38. Συλλέχθηκαν κλάσματα του 1 ml και εκείνα με πυκνότητα 1,16 έως 1,22 g/ml συγκεντρώθηκαν, αραιώθηκαν σε 20% (w/w) σακχαρόζη και ο ιός σφαιροποιήθηκε στα 90000g για 3 ώρες στους 4 °C σε περιστρεφόμενο ρότορα MSE 3 x 25. Ο ιοί που αποβλήθηκαν (2 έως 4 mg πρωτεΐνης) επαναιωρήθηκαν σε 1 ml I M-KCI ή 1 M-NaC1 σε NET και 1 ml 4% (v/v) Nonidet P40 (NP40) σε NET που περιείχε 1 M-KCI ή 1 M-NaCI, ακολουθούμενο από ηχοβολισμό για 2 έως 3 s και επώαση στους 25 °C για 1 ώρα. Το αδιάλυτο υλικό απομακρύνθηκε με φυγοκέντρηση χαμηλής ταχύτητας και το υπερκείμενο τοποθετήθηκε σε διαβάθμιση σακχαρόζης 10 έως 55% (w/w) σε NET που περιέχει 1 M-KC1 ή 1 M-NaC1 και 0,1 ~ NP40. Μετά από φυγοκέντρηση σε περιστρεφόμενο ρότορα MSE 6 x 38 σε 85.000 gav για 16 ώρες στους 4 °C συλλέχθηκαν κλάσματα των 500 pi. Αυτά διαλύθηκαν για την απομάκρυνση του KCI, κατά περίπτωση, πριν από την ηλεκτροφόρηση. Η ηλεκτροφόρηση σε πηκτή SDS-πολυακρυλαμιδίου (SDS-PAGE) πραγματοποιήθηκε σε σωλήνες και πλάκες με πηκτή διάλυσης ακρυλαμιδίου 10% (Cavanagh, 1981). Τα δείγματα διαχωρίστηκαν σε θερμοκρασία δωματίου με 2% SDS και 2% (v/v) 2-μερκαπτοαιθανόλη. Οι μη επισημασμένοι δείκτες που χρησιμοποιήθηκαν ήταν η φωσφορυλάση b, η αλβουμίνη ορού βοοειδών και η καρβονική ανυδράση- κάποια φωσφορυλάση είχε προχρωματιστεί με Drimarine brilliant blue K-BL (Bosshard & Datyner, 1977) και το φαινόμενο mol. wt. ήταν 110K".
"Έτσι, οι μελέτες αυτές δείχνουν ότι τα πεπλομερή του IBV περιλαμβάνουν δύο γλυκοπολυπεπτίδια των 90K και 84K σε ισομοριακή αναλογία. Τα πολυπεπτίδια των 110Κ και 75Κ, που ανιχνεύονται μεταβλητά σε παρασκευάσματα του ιού, είναι πιθανώς πολυπεπτίδια του ξενιστή".
doi: 10.1099/0022-1317-64-8-1787.
--> 1985
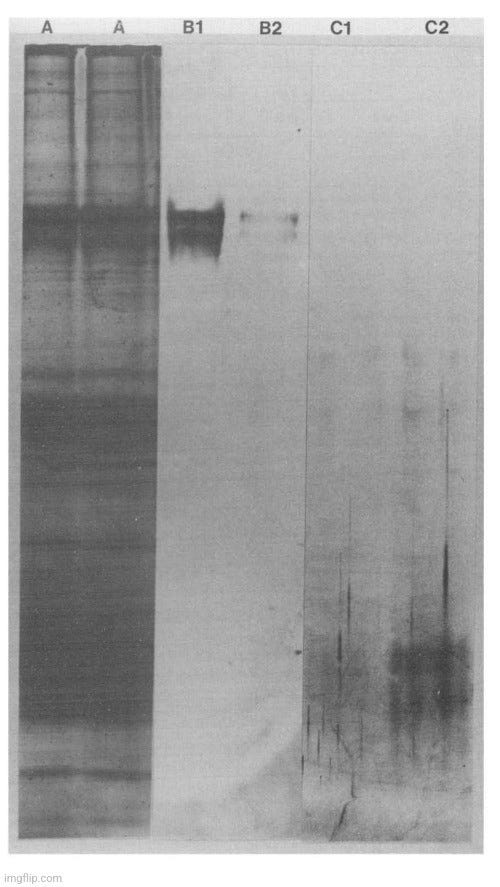
Στη μελέτη αυτή χρησιμοποιήθηκε χρωματογραφία συγγένειας για τον "καθαρισμό" "ιών" που καλλιεργήθηκαν σε κυτταρικές καλλιέργειες. Ωστόσο, λάβετε υπόψη ότι είναι γνωστό ότι η τεχνική αυτή δεν μπορεί να διαχωρίσει τους "ιούς" από τα εξωσώματα ή άλλα σωματίδια με το ίδιο μέγεθος, σχήμα και πυκνότητα. Οι ερευνητές βασίζονται επίσης σε θεωρητικές αντιδράσεις μονοκλωνικών αντισωμάτων για τον εντοπισμό των "ιικών" πρωτεϊνών μέσα από ένα ακατέργαστο μείγμα άλλων πρωτεϊνών, οι οποίες λέγεται ότι δεν είναι "ιικές" πρωτεΐνες με βάση τη μη ειδική μέτρηση των θεωρητικών αντισωμάτων. Αναφέρεται ότι υπήρχαν και άλλες βαμμένες ζώνες κατά την ηλεκτροφόρηση πηκτώματος και ότι πρόκειται για τεχνουργήματα που παρατηρούνται μερικές φορές, ακόμη και απουσία πρωτεΐνης, με αυτή τη διαδικασία χρώσης. Δεν σκιαγραφήθηκαν κατάλληλοι έλεγχοι και η μόνη εικόνα ήταν των ζωνών από τα πειράματα ηλεκτροφόρησης σε πηκτή:
--> Πρωτεΐνες του φακέλου του ιού της λοιμώδους βρογχίτιδας των πτηνών: Καθαρισμός και βιολογικές ιδιότητες
Ιός
Το στέλεχος Μ41 του IBV της Μασαχουσέτης καλλιεργήθηκε στις αλλαντοειδείς κοιλότητες εμβρυοποιημένων αυγών κοτόπουλου ηλικίας 11 ημερών και καθαρίστηκε σε ισοπυκνικές κλίσεις σακχαρόζης, όπως περιγράφεται από τον Cavanagh (1981).
Προετοιμασία υλικού για χρωματογραφία συγγένειας
Ο καθαρισμένος ιός σφαιροποιήθηκε σε ρότορα 6 X 14 ml σε 70.000 X g για 3 ώρες στους 4°C και επανασυσσωματώθηκε σε φυσιολογικό ορό με ρυθμισμένο φωσφορικό οξύ (PBS). Προστέθηκε ίσος όγκος PBS που περιείχε 4% (wt./vol.) NP40, αναμείχθηκε με ομογενοποιητή Dounce και επωάστηκε για 2 ώρες στους 25°C. Το υλικό φυγοκεντρήθηκε για 5 λεπτά σε μικροφυγόκεντρο Eppendorf και το υπερκείμενο που προέκυψε, το οποίο περιείχε διαλυτά ιικά συστατικά, χρησιμοποιήθηκε για τον καθαρισμό με χρωματογραφία συγγένειας.
Παρασκευή ανοσοπροσροφητή
Παρασκευάστηκαν μονοκλωνικά αντισώματα (με τις ονομασίες A38 και C24) για την ακίδα και τη μεμβρανική πρωτεΐνη αντίστοιχα του στελέχους M41 του IBV (Mockett et al., 1984). Το κλάσμα γαμμασφαιρίνης των ασκιτικών υγρών που περιείχε είτε μονοκλωνικά αντισώματα κατά της ακίδας είτε κατά της μεμβράνης απομονώθηκε με καταβύθιση άλατος χρησιμοποιώντας τελική συγκέντρωση 18% (κ.β./όγκο) Na2SO4. Για τον ανοσοπροσροφητή spike 5,6 mg γαμμασφαιρίνης συνδέθηκαν με 0,75 mg CNBr-Sepharose 4B (Pharmacia) σύμφωνα με τις οδηγίες του κατασκευαστή και για τον ανοσοπροσροφητή μεμβράνης 5,5 mg συνδέθηκαν με την ίδια ποσότητα πηκτής. Οι μη αντιδραστικές ομάδες στο πήκτωμα μπλοκαρίστηκαν με αιθανολαμίνη 1 Μ, pit 8,0, και τυχόν μη ομοιοπολικά συνδεδεμένες πρωτεΐνες απομακρύνθηκαν με επαναλαμβανόμενες πλύσεις με ρυθμιστικό διάλυμα 0,1 Μ NaHCO~, pH 8,3, που περιέχει0,5 Μ NaCI και ρυθμιστικό διάλυμα 0,1 Μ οξικού οξέος, pH 4,4, που περιέχει 0,5 Μ NaCI. Το ανοσοπροσροφητικό αποθηκεύτηκε σε PBS που περιείχε 0,2% NaN3 στους 4°C μέχρι να χρησιμοποιηθεί. Πλύθηκε δύο φορές με 3 M NH4SCN σε PBS που περιείχε 0,1% οκτυλογλυκοζίτη, τέσσερις φορές με PBS και δύο φορές με PBS που περιείχε 2% NP40 πριν από τη χρήση. Όλοι οι όγκοι πλύσης ήταν 10 ml.
Χρωματογραφία συγγένειας
Το διαλυτοποιημένο παρασκεύασμα ιού αναμίχθηκε με το ανοσοπροσροφητικό για 16 ώρες στους 4°C με τη χρήση περιστροφικού αναδευτήρα. Το πήκτωμα χύνεται σε στήλη χρωματογραφίας και πλένεται με PBS που περιέχει 0,1% NP40 (40 ml) και PBS που περιέχει 0,1% οκτυλογλυκοζίτη (10 ml). Προστέθηκε 3 M NH,SCN σε PBS που περιέχει 0,1% οκτυλογλυκοζίτη και συλλέχθηκαν 10 κλάσματα του 1 ml. Η απορρόφηση στα 280 nm καθενός από τα κλάσματα μετρήθηκε με φασματοφωτόμετρο SP1800 PyeUnicam. Τα κλάσματα στην κορυφή απορρόφησης διαλύθηκαν με PBS. Ένα δείγμα από κάθε κλάσμα υποβλήθηκε στη συνέχεια σε ηλεκτροφόρηση σε πηκτή πολυακρυλαμιδίου. Τα κλάσματα που περιείχαν ανιχνεύσιμη ιική πρωτεΐνη συγκεντρώθηκαν και αποτέλεσαν το παρασκεύασμα της καθαρισμένης πρωτεΐνης".
"Οι ιϊκές πρωτεΐνες που καθαρίστηκαν με χρωματογραφία συγγένειας παρουσιάζονται στην Εικ. 1. Η πρωτεΐνη spike, η οποία αποτελείται από δύο πολυπεπτίδια, ήταν η μόνη πρωτεΐνη που ανιχνεύθηκε στα δύο κλάσματα που παρουσιάζονται με τη χρήση της ευαίσθητης διαδικασίας χρώσης με άργυρο. Ομοίως, η πρωτεΐνη της μεμβράνης δεν επιμολύνθηκε με άλλες πρωτεΐνες, αν και η πρωτεΐνη αυτή δεν χρωματίστηκε τόσο καλά όσο η spike. Υπήρχαν και άλλες χρωματισμένες ζώνες, αλλά πρόκειται για τεχνουργήματα που παρατηρούνται μερικές φορές, ακόμη και απουσία πρωτεΐνης, με αυτή τη διαδικασία χρώσης".
Η παρούσα εργασία περιγράφει την εφαρμογή της χρωματογραφίας συγγένειας με χρήση μονοκλωνικών αντισωμάτων για τον καθαρισμό των δύο δομικών πρωτεϊνών του ιού που υπάρχουν στην επιφάνεια του ιού IB - της ακίδας και της μεμβράνης. Σε προηγούµενη έκθεση έχουν περιγραφεί διαδικασίες για τον καθαρισµό αυτών των ιικών πρωτεϊνών καθώς και της πρωτεΐνης του νουκλεοκαψιδίου, της µόνης άλλης σηµαντικής δοµικής πρωτεΐνης (Cavanagh, 1983). Ο IBV διαλυτοποιήθηκε σε απορρυπαντικό NP40 και φυγοκεντρήθηκε σε βαθμίδα σακχαρόζης που περιείχε αυτό το απορρυπαντικό για τον καθαρισμό της πρωτεΐνης του πυρηνοκαψιδίου. Η προσθήκη 1 Μ NaCI στα διαλύματα σακχαρόζης απαιτήθηκε για τον καθαρισμό της ακίδας και των μεμβρανικών πρωτεϊνών, καθώς αυτές συν-μεγαλοποιούνται σε βαθμίδες που περιέχουν χαμηλές συγκεντρώσεις αλάτων. Ωστόσο, η πρωτεΐνη του νουκλεοκαψιδίου δεν μπορούσε να καθαριστεί σε βαθμίδες που περιείχαν υψηλές συγκεντρώσεις αλάτων. Η απόδοση του υλικού από αυτές τις κλίσεις ήταν σχετικά χαμηλή, λόγω του περιορισμένου αριθμού κλασμάτων που περιείχαν καθαρισμένα ιικά συστατικά. Σε άλλες µελέτες (Cavanagh, 1984) το καθαρισµένο υλικό των αιχµών περιείχε κάποια πρωτεΐνη νουκλεοκαψιδίου και το παρασκεύασµα µεµβράνης περιείχε άλλες πρωτεΐνες που θεωρήθηκε ότι ήταν κυτταρικής προέλευσης.
Η χρήση χρωματογραφίας συγγένειας έχει πολλά πλεονεκτήματα. Αξιοποιώντας την ειδικότητα του αντισώματος μπορεί να απομονωθεί καθαρό υλικό, ακόμη και από ένα ακατέργαστο μείγμα πρωτεϊνών. Η μέθοδος είναι πολύ γρήγορη και εύκολη και το ανοσοπροσροφητικό μπορεί να χρησιμοποιηθεί αρκετές φορές. Έτσι, μπορούν να ληφθούν σχετικά μεγάλες ποσότητες καθαρού υλικού. Η διαθεσιμότητα των ακίδων και των μεμβρανικών πρωτεϊνών σε εξαιρετικά καθαρισμένη μορφή θα επιτρέψει τη διεξαγωγή περισσότερων βιοχημικών, δομικών και ανοσολογικών μελετών".
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7119818/#__ffn_sectitle
--> 1990
Σε αυτή την πρώτη από τις δύο μελέτες του 1990, η χρωματογραφία συγγένειας χρησιμοποιείται για άλλη μια φορά για την προσπάθεια "καθαρισμού" από υπερκείμενο κυτταροκαλλιέργειας. Αυτή τη φορά τα κύτταρα που χρησιμοποιήθηκαν είχαν τη μορφή DBT, τα οποία είναι κύτταρα όγκου εγκεφάλου ποντικού που λέγεται ότι έχουν μετασχηματιστεί από τον "ιό" του σαρκώματος Rous. Ο "ιός" MHV πασάρεται τέσσερις φορές και παράγεται σε μέσο που περιέχει ορό εμβρύου μοσχαριού, ο οποίος, και πάλι, αποτελεί πηγή πολλών συστατικών του ίδιου του ξενιστή/κυττάρου. Διάφορα άλλα χημικά πρόσθετα χρησιμοποιήθηκαν καθ' όλη τη διάρκεια των διεργασιών και στο τέλος, έγινε δεκτό ότι στα δείγματα υπήρχε αναπαραγώγιμα "μη-ιικό" υλικό ξενιστή. Δεν παρουσιάστηκαν εικόνες ΗΜ των καθαρισμένων/απομονωμένων πρωτεϊνών αιχμής πέραν των κηλίδων ηλεκτροφόρησης πηκτής:
--> Προστασία ποντικών από θανατηφόρα μόλυνση από τον κοροναϊό MHV-A59 με μονοκλωνική γλυκοπρωτεΐνη Spike που έχει καθαριστεί με συγγένεια
"Κύτταρα και ιός
Το στέλεχος A59 του MHV (MHV-A59), το οποίο ελήφθη από την American Type Culture Collection (Rockville, MD, U.S.A.), καθαρίστηκε δύο φορές με πλάκες και πασάρεται τέσσερις φορές με πολλαπλότητα μόλυνσης (MOl) O.Ol σε κύτταρα DBT.
Προετοιμασία αντιγόνου
Ο ιός παρήχθη όπως περιγράφηκε προηγουμένως σε μέσο καλλιέργειας που περιείχε 1 % (v/v) FCS. Οι μονοστιβάδες κυττάρων DBT μολύνθηκαν με MHV-AS9 σε MOl 0,01 και το μέσο συλλέχθηκε 16 ώρες μετά τη μόλυνση. Τα υπολείμματα των κυττάρων σφαιροποιήθηκαν και ο ιός συμπυκνώθηκε με καθίζηση με 10% (w/v) πολυαιθυλενογλυκόλη σε O.S M NaCl. Τα ιικά αντιγόνα ανασυγκροτήθηκαν και διαλύθηκαν έναντι ρυθμιστικού διαλύματος TMEN (0,1 M Tris-acid-maleate, pH 6,2, 0,1 M NaC!, 1 mM EDTA) και διατηρήθηκαν στους -70°C μέχρι να χρησιμοποιηθούν. Σε ορισμένα πειράματα, ο ιός επισημάνθηκε με την προσθήκη 4 mCi [3SS]μεθειονίνης (ICN Biochemicals Canada, Ville St-Laurent, PQ, Canada) στο μέσο καλλιέργειας 6 ώρες μετά τη μόλυνση.
Χρωματογραφία συγγένειας
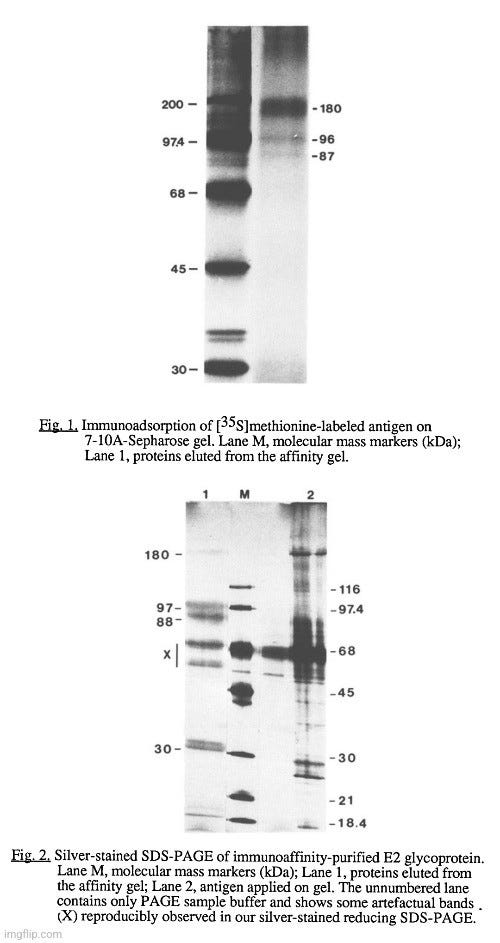
Το ανοσοαπορροφητικό υλικό E2/S παρασκευάστηκε με τη σύζευξη πέντε χιλιοστογραμμαρίων καθαρισμένης MAb 7-10A 11 σε 1 g ενεργοποιημένης με CNBr Sepharose 4B (Pharmacia, Dorval, PQ, Canada), όλα τα βήματα έγιναν σύμφωνα με τις οδηγίες του κατασκευαστή. Για τη χρωματογραφία συγγένειας, ο συμπυκνωμένος ιός διαλυτοποιήθηκε με 2% (v/v) Nonidet P-40 (NP-40) για 2 ώρες σε θερμοκρασία δωματίου (RT) και οι διαλυτές πρωτεΐνες αναμίχθηκαν με την πηκτή 7-lOA-Sepharose και επωάστηκαν με το ένα άκρο προς το άλλο για 16 ώρες στους 4°C. Η ειδικότητα της πηκτής προσδιορίστηκε με ανοσοπροσρόφηση ραδιοσημασμένου αντιγόνου, εκτεταμένη πλύση με 0,1% (v/v) NP-40 (σε ρυθμιστικό διάλυμα φωσφορικών 0,2 Μ, pH 6,2, 0,1 Μ NaC!, 1mM EDTA) και έκλουση των προσροφημένων πρωτεϊνών σε ρυθμιστικό διάλυμα δείγματος ηλεκτροφόρησης. Διαφορετικά, η πηκτή χύνεται σε στήλη και πλένεται μέχρι η απορρόφηση στα 280 nm να πέσει στα επίπεδα της βασικής γραμμής, οπότε η στήλη πλένεται με 4 όγκους πηκτής του ίδιου ρυθμιστικού διαλύματος που περιέχει 0,1 % (w/v) οκτυλογλυκοζίτη για αντικατάσταση του απορρυπαντικού. Η έκλουση πραγματοποιήθηκε με την προσθήκη ισοθειοκυανικού αμμωνίου 3 Μ στο τελευταίο διάλυμα. Κλάσματα των 1 ml συλλέχθηκαν και διηθήθηκαν με διττανθρακικό αμμώνιο O,O5 M, pH 7,4. Ένα δείγμα από κάθε κλάσμα λυοφιλοποιήθηκε, επαναιωρήθηκε σε ρυθμιστικό διάλυμα δείγματος ηλεκτροφόρησης και αναλύθηκε σε πηκτή γραμμικού πολυακρυλαμιδίου 7-1S%, πριν από τη φθοριογράφηση με Enlightning® (Dupont Canada, Lachine, PQ, Canada) για ραδιοσημασμένο αντιγόνο ή χρώση αργύρουl2. Τα κλάσματα που περιείχαν καθαρισμένο E2/S συγκεντρώθηκαν και χρησιμοποιήθηκαν για ανοσολογικές μελέτες".
Καθαρισμός και ανοσογονικότητα της γλυκοπρωτεΐνης E2/S
Η γλυκοπρωτεΐνη E2/S που χρησιμοποιήθηκε για τις μελέτες ανοσογονικότητας καθαρίστηκε από ιικά αντιγόνα που συμπυκνώθηκαν από 1,8 λίτρα μέσου καλλιέργειας από κύτταρα DBT που είχαν μολυνθεί με MHV -A59. Τα κλάσματα που εκλούστηκαν μετά τη χρωματογραφία ανοσοαφινικότητας αναλύθηκαν με SDS-PAOE και χρώση αργύρου. Το Σχήμα 2 δείχνει ότι οι διμερείς και μονομερείς μορφές του E2/S καθαρίστηκαν χωρίς ανιχνεύσιμη επιμόλυνση από άλλες ιικές πρωτεΐνες. Ωστόσο, παρατηρήθηκε αναπαραγώγιμα μια επιμόλυνση (30 kDa), η οποία ήταν πιθανώς κυτταρικής προέλευσης. Η καθαρισμένη γλυκοπρωτεΐνη ήταν μερικώς μετουσιωμένη, όπως επιβεβαιώθηκε από την απώλεια της αντιδραστικότητάς της με το MAb 7-10A (δεδομένα δεν παρουσιάζονται)".
https://link.springer.com/chapter/10.1007/978-1-4684-5823-7_28
Αυτή η δεύτερη μελέτη από το 1990 είναι κυρίως μια ορολογική μελέτη η οποία χρησιμοποίησε επίσης τεχνικές καλλιέργειας κυττάρων για να αποκτήσει τον "ιό" που μελετήθηκε. Ο HEV λέγεται ότι "απομονώθηκε" με ρινικό επίχρισμα από χοίρο όπου καλλιεργήθηκε σε κύτταρα MDCK I από σκύλο και "καθαρίστηκε" με φυγοκέντρηση μέσω διαβάθμισης σακχαρόζης. Λάβετε υπόψη ότι η φυγοκέντρηση με διαβάθμιση σακχαρόζης, παρόλο που θεωρείται το "χρυσό πρότυπο", δεν μπορεί να καθαρίσει/απομονώσει πλήρως σωματίδια του ίδιου μεγέθους, σχήματος και πυκνότητας. Δεν υπήρχαν εικόνες ΕΜ των πρωτεϊνών αιχμής πέραν των κηλίδων μελανιού ηλεκτροφόρησης σε πηκτή που παρουσιάζονται παρακάτω. Οι πρωτεΐνες ισχυρίστηκαν ότι ανιχνεύονται ορολογικά με βάση τις κηλίδες. Οι μέθοδοι που χρησιμοποιήθηκαν για τη λήψη των αποτελεσμάτων ήταν επίσης ανεπαρκώς καθορισμένες χωρίς προφανείς ελέγχους:
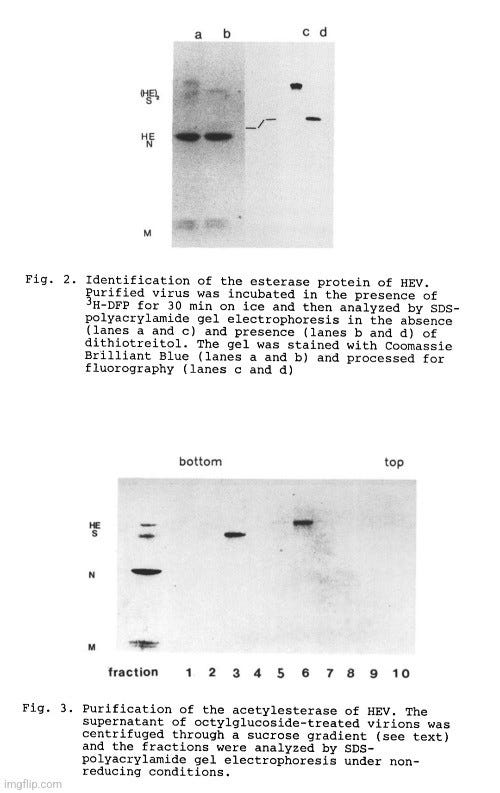
--> Απομόνωση και χαρακτηρισμός της ακετυλεστεράσης του ιού της εγκεφαλομυελίτιδας με αιμοσφαιρίτιδα (HEV).
Ο HEV σχετίζεται με τον BCV τόσο ορολογικά όσο και ως προς την αιμοσυγκολλητικές ιδιότητες. Αναλύσαμε αν ο HEV έχει επίσης δραστικότητα ακετυλεστεράσης όπως το στέλεχος BCV NT-9 του HEV, το οποίο έχει απομονωθεί με ρινικό επίχρισμα από χοίρο (Heb and Bachmann, 1978), αναπτύχθηκε σε κύτταρα MDCK I και καθαρίστηκε με φυγοκέντρηση μέσω διαβάθμισης σακχαρόζης. Ο καθαρισμένος ιός αναλύθηκε ως προς την ικανότητά του να απελευθερώνει οξικό άλας από p-νιτροφαινυλακετικό (PNPA)
"Ο καθαρισμένος HEV επωάστηκε με 3H- DFP για 30 λεπτά στους 4°C και στη συνέχεια αναλύθηκε με ηλεκτροφόρηση σε πηκτή SDS-πολυακρυλαμιδίου. Το αποτέλεσμα παρουσιάζεται στην Εικ. 2. Μετά από χρώση με Coomassie Brilliant Blue έγιναν ορατές οι ιικές πρωτεΐνες N, M, S και HE. Διαπιστώθηκε ότι η ραδιενεργός σήμανση ταυτίζεται μόνο με την τελευταία γλυκοπρωτεΐνη. Η ταυτότητα της πρωτεΐνης που επισημαίνεται με 3H-DFP επιβεβαιώθηκε με την ανάλυση του δείγματος απουσία και παρουσία αναγωγικών παραγόντων. Υπό μη αναγωγικές συνθήκες η επισημασμένη πρωτεΐνη ανιχνεύθηκε σε θέση που αναμενόταν για πρωτεΐνη με μοριακό βάρος περίπου 140 kDal. Παρουσία διθειοτρεϊτόλης το φαινόμενο μέγεθος μειώνεται σε περίπου 65 kDal υποδεικνύοντας ότι στη μητρική πρωτεΐνη τα μονομερή συνδέονται με δισουλφιδικούς δεσμούς για να σχηματίσουν για να σχηματίσουν μια διμερή δομή. Αυτή η συμπεριφορά μετανάστευσης είναι χαρακτηριστική για την ιική πρωτεΐνη που εμπλέκεται στην αιμοσυγκολλητική δραστηριότητα του HEV (Callebaut and Pensaert, 1980) και ως εκ τούτου, κατ' αναλογία με τον BCV, χαρακτηρίζεται ως HE.
Προκειμένου να απομονωθεί η εστεράση του HEV από την ιική μεμβράνη, τα καθαρισμένα ιούς υποβλήθηκαν σε επεξεργασία με 1% οκτυλογλυκοζίτη (OG). Το νουκλεοκαψίδιο καθώς και η Μ-πρωτεΐνη διαχωρίστηκαν με φυγοκέντρηση για 30 λεπτά στα 25.000 x g (δεν φαίνεται). Οι γλυκοπρωτεΐνες που παρέμεναν στο υπερκείμενο (S και HE) φορτώθηκαν σε διαβάθμιση σακχαρόζης 10-30% σε PBS που περιείχε 1% OG. Μετά από φυγοκέντρηση στις 42.000 rpm για 16 ώρες σε ρότορα SW55, τα κλάσματα συλλέχθηκαν από τον πυθμένα του σωλήνα και αναλύθηκαν με ηλεκτροφόρηση σε πηκτή SDS-πολυακρυλαμιδίου. Όπως φαίνεται στην Εικ. 3, η S-πρωτεΐνη ανιχνεύθηκε στο κλάσμα 3, ενώ το μεγαλύτερο μέρος της HE ανακτήθηκε από το κλάσμα 6. Η ανάλυση των κλασμάτων ως προς τη δραστικότητα της ακετυλεστέρασης αποκάλυψε ότι μόνο τα κλάσματα που περιείχαν HE ήταν ικανά να απελευθερώσουν οξικό άλας από το PNPA. Το αποτέλεσμα αυτό επιβεβαιώνει ότι η HE είναι υπεύθυνη για την εστεράση δραστικότητα της HEV".
https://link.springer.com/chapter/10.1007/978-1-4684-5823-7_16
--> 1991
Στην τελευταία αυτή μελέτη, ο BCV αναπτύχθηκε σε κύτταρα MDCK I, μια υποκατηγορία κυττάρων Madin-Darby κυνικών νεφρών. Για άλλη μια φορά, χρησιμοποιήθηκε υπερφυγοκέντρηση για να "καθαριστεί" το ήδη μολυσμένο και ακάθαρτο παρασκεύασμα με την προσθήκη ρυθμιστικού φυσιολογικού ορού φωσφορικών αλάτων και άλλων χημικών ουσιών, όπως n-οκτυλογλυκοπυρανοσίδη, ένα μη ιοντικό απορρυπαντικό που χρησιμοποιείται για τη διαλυτοποίηση των πρωτεϊνών της μεμβράνης. Οι ερευνητές χρησιμοποίησαν στη συνέχεια εικόνες ΗΜ για να διαπιστώσουν ότι η πρωτεΐνη S, που χαρακτηρίζεται ως ο μακρύς βραχίονας προβολής του "ιού", πρέπει εύλογα να υποτεθεί ότι χρησιμοποιείται από τον "ιό" για να προσκολληθεί στα κύτταρα προκειμένου να τα καταλάβει, καθώς θα συναντήσει πρώτο το κύτταρο... καθώς είναι μακρύτερο.
--> Η πρωτεΐνη S του κοροναϊού των βοοειδών είναι αιμοσυγκολλητίνη που αναγνωρίζει το 9-0-ακετυλιωμένο σιαλικό οξύ ως καθοριστικό υποδοχέα
"Ιοί και κύτταρα. Το στέλεχος L-9 του BCV ελήφθη από την R.Rott (Giessen, Γερμανία). Τα κύτταρα MDCK I, μια υποκατηγορία των κυττάρων του κυνικού νεφρού Madin-Darby, διατηρήθηκαν όπως περιγράφηκε προηγουμένως (6).
Ανάπτυξη και καθαρισμός του ιού. Ο BCV αναπτύχθηκε σε κύτταρα MDCK I όπως αναφέρθηκε πρόσφατα (20). Ο ιός συλλέχθηκε από το υπερκείμενο των μολυσμένων κυττάρων MDCK I 48 ώρες μετά τη μόλυνση. Μετά τη διαύγαση του μέσου με φυγοκέντρηση χαμηλής ταχύτητας (2.000 x g, 10 λεπτά), ο ιός καθιζάνονταν με υπερφυγοκέντρηση σε 112.000 x g για 1 ώρα. Το σφαιρίδιο επαναιωρήθηκε σε φυσιολογικό ορό ρυθμισμένο με φωσφορικά άλατα (PBS) και τοποθετήθηκε σε βαθμίδα σακχαρόζης (5 έως 50% [wt/wt] σε PBS). Μετά από φυγοκέντρηση στα 148.000 x g για 40 λεπτά, η ζώνη του ιού συλλέχθηκε, αραιώθηκε με PBS και καθιζάνονταν υπό τις ίδιες συνθήκες φυγοκέντρησης. Το σφαιρίδιο του ιού ανασυστάθηκε σε PBS και χρησιμοποιήθηκε για τον καθαρισμό των ιικών γλυκοπρωτεϊνών.
Απομόνωση και καθαρισμός των ιικών γλυκοπρωτεϊνών. Οι ιικές γλυκοπρωτεΐνες απομονώθηκαν με κατεργασία με n-οκτυλογλυκοπυρανοσίδη και καθαρίστηκαν με φυγοκέντρηση με βαθμίδα σακχαρόζης, όπως περιγράφηκε πρόσφατα (21)".
"Λόγω της αποτελεσματικότητας της S πρωτεΐνης στην αναγνώριση υποδοχέων που περιέχουν Neu5,9Ac2, είναι λογικό να υποθέσουμε ότι η πρωτογενής προσκόλληση αυτών των κορονοϊών διαμεσολαβείται από την πρωτεΐνη S και όχι από την HE. Το συμπέρασμα αυτό συμφωνεί με την ηλεκτρονική μικροσκοπική παρατήρηση των ιικών γλυκοπρωτεϊνών. Είναι ορατές ως διπλός κρόκος προεξοχών στην επιφάνεια του ιού (4). Η πρωτεΐνη HE, η οποία είναι μικρότερη σε μέγεθος, σχηματίζει το εσωτερικό στρώμα των προεξοχών.
Τα πεπλομερή, τα οποία είναι χαρακτηριστικά των κορονοϊών, σχηματίζουν το εξωτερικό στρώμα των αιχμών και αποτελούνται από την πρωτεΐνη S. Έτσι, κάθε φορά που ένα σωματίδιο του ιού πλησιάζει ένα κύτταρο, οι κυτταρικοί υποδοχείς θα συναντήσουν πρώτα την πρωτεΐνη S. Για τους κορονοϊούς που δεν διαθέτουν πρωτεΐνη HE, όπως ο ιός της λοιμώδους βρογχίτιδας των πτηνών, έχει αποδειχθεί ότι η S είναι η πρωτεΐνη προσκόλλησης (1). Από τα αποτελέσματα που παρουσιάζονται εδώ, προτείνουμε ότι η προσκόλληση όλων των κορονοϊών στις κυτταρικές επιφάνειες διαμεσολαβείται από την πρωτεΐνη S, ανεξάρτητα από τον τύπο των υποδοχέων που αναγνωρίζονται".
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC250319/
--> Συνοπτικά:
Στοιχεία σχετικά με την αποτελεσματικότητα των εμβολίων (VE) κατά της συμπτωματικής νόσου και της σοβαρής νόσου αναμένεται να γίνουν διαθέσιμα μόνο όταν τα παραλλαγμένα και επικαιροποιημένα εμβόλια θα έχουν εισαχθεί σε ευρύτερη χρήση
Με άλλα λόγια, δεν θα ξέρουν πόσο καλά λειτουργεί το εμβόλιό τους μέχρι αρκετοί από τους φοβισμένους και αφελείς να σηκώσουν τα μανίκια τους και να κάνουν το βήμα... ΕΠΙΣΤΗΜΗ!!!
Από τα πρώτα εμβόλια mRNA, υπήρξε συνεχής και ουσιαστική εξέλιξη του ιού "SARS CoV-2", ιδιαίτερα στην πρωτεΐνη αιχμής (S)
Αυτές οι γονιδιωματικές αλλαγές στον "ιό" έχουν οδηγήσει σε διάφορους VOC που έχουν κυκλοφορήσει κατά κύματα, με διαφορετικούς βαθμούς ανοσολογικής αποφυγής, μερικοί από τους οποίους έχουν οδηγήσει σε χαμηλότερη VE των υφιστάμενων εμβολίων "COVID-19" σε σύγκριση με την αρχική VE έναντι του δείκτη "ιού"
Το μέγεθος της μείωσης της αποτελεσματικότητας του εμβολίου ποικίλλει ανάλογα με:
Το προϊόν
Το Πρόγραμμα
Την Έκβαση της νόσου
Την Ανησυχητική παραλλαγή (VOC)
Τον Χρόνο από την τελευταία δόση
Η προστασία έναντι της λοίμωξης και της συμπτωματικής νόσου λόγω της παραλλαγής Omicron είναι χαμηλότερη από άλλες παραλλαγές και μειώνεται ταχέως, ακόμη και μετά από μια τρίτη (αναμνηστική) δόση
Παραμένουν όσοι διατρέχουν τον υψηλότερο κίνδυνο για σοβαρή νόσο, νοσηλεία και θάνατο:
Ηλικιωμένα άτομα
Τα άτομα με συννοσηρότητες και ανοσοκατασταλτικές καταστάσεις
Άλλοι ευάλωτοι πληθυσμοί
Με άλλα λόγια, τα εμβόλια δεν έχουν αλλάξει απολύτως τίποτα, καθώς το 99% των ανθρώπων που δεν κινδύνευαν εξακολουθούν να μην κινδυνεύουν και όσοι κινδύνευαν από τη νόσο παραμένουν έτσι
Σύμφωνα με το CDC, τα εμβόλια mRNA χρησιμοποιούν mRNA που δημιουργείται σε ένα εργαστήριο για να διδάξουν στα κύτταρά μας (επειδή το σώμα είναι προφανώς ηλίθιο) πώς να φτιάξουν μια πρωτεΐνη -ή ακόμα και μόνο ένα κομμάτι μιας πρωτεΐνης- που πυροδοτεί μια ανοσολογική απάντηση μέσα στο σώμα μας
Αυτή η ανοσολογική απόκριση, η οποία παράγει αντισώματα, είναι αυτό που μας βοηθά να προστατευτούμε από το να αρρωστήσουμε από αυτό το μικρόβιο στο μέλλον (μόνο που δεν το κάνει και οι άνθρωποι εξακολουθούν να αρρωσταίνουν μετά τη "μόλυνση")
Η διαδικασία περιγράφεται ως εξής:
Μετά τον εμβολιασμό, το mRNA θα εισέλθει στα μυϊκά κύτταρα και μόλις εισέλθει, χρησιμοποιεί τους μηχανισμούς των κυττάρων για να παράγει ένα ακίνδυνο κομμάτι αυτού που ονομάζεται ακίδα πρωτεΐνης spike
Αφού παραχθεί το κομμάτι της πρωτεΐνης, τα κύτταρά μας διασπούν το mRNA και το απομακρύνουν (κάτι που υποτίθεται αλλά ποτέ δεν παρατηρείται)
Στη συνέχεια, τα κύτταρά μας εμφανίζουν το κομμάτι της πρωτεΐνης spike στην επιφάνειά τους και το ανοσοποιητικό μας σύστημα αναγνωρίζει ότι η πρωτεΐνη δεν ανήκει εκεί
Στο τέλος της διαδικασίας, ο οργανισμός μας έχει μάθει πώς να συμβάλλει στην προστασία από μελλοντική μόλυνση με τον "ιό που προκαλεί το COVID-19" (μόνο που δεν το κάνει, καθώς οι εμβολιασμένοι άνθρωποι " επαναμολύνονται" συνεχώς)
Τυχόν παρενέργειες από τη λήψη του εμβολίου είναι φυσιολογικά σημάδια ότι ο οργανισμός δημιουργεί προστασία (δηλαδή οι παρενέργειες είναι ένα φυσιολογικό σημάδι ότι ο οργανισμός έχει δηλητηριαστεί και εργάζεται για να απαλλαγεί από το δηλητήριο)
Οι "κορονοϊοί", ισχυρίζονται συχνά ότι. έχουν μια χαρακτηριστική μορφολογία, συμπεριλαμβανομένης της κατοχής μιας επιφανειακής προεξοχής σε σχήμα "ρόπαλου" ή μιας γλυκοπρωτεΐνης αιχμής (S).
Ωστόσο, από κοινού με άλλες πτυχές των "κορονοϊών", η ομάδα παρουσιάζει παραλλαγές όσον αφορά το σχήμα, το μέγεθος και την κατανομή της πρωτεΐνης S στην επιφάνεια του "ιού".
Οι διαστάσεις της S ποικίλλουν όχι μόνο μεταξύ των "κοροναϊών" αλλά και ανάλογα με τη διαδικασία χρώσης
Ο καθαρισµός της πρωτεΐνης S των MHV, IBV, HCV στέλεχος 229E, "κοροναϊού" βοοειδών (BCV) και "ιού" της εγκεφαλοµυελίτιδας των χοίρων (HEV) λέγεται ότι επιτυγχάνεται µε τη χρήση συνδυασµού µη ιοντικού απορρυπαντικού και φυγοκέντρησης µε βαθµίδα σακχαρόζης και µε χρωµατογραφία συγγένειας.
Στην αρχική εργασία καθαρισμού/απομόνωσης πρωτεϊνών αιχμής του 1980 που παρατίθεται από τον David Cavanagh, βλέπουμε:
-- Οι λόγοι για την προφανή ποικιλομορφία στα πολυπεπτιδικά πρότυπα των "κορονοϊών" δεν είναι πλήρως κατανοητοί
-- Οι διαφορές στην τεχνική και η ατελής διάκριση των πολυπεπτιδίων "ιού" από εκείνα που προέρχονται από τον ξενιστή μπορεί να ευθύνονται για ορισμένες από τις διαφορές
-- Ωστόσο, ακόµη και όταν χρησιµοποιούνται τα ίδια συστήµατα πηκτής και οι ίδιες συνθήκες στο ίδιο εργαστήριο, έχουν παρατηρηθεί σηµαντικές διαφορές στον αριθµό και το µέγεθος των πολυπεπτιδίων "ιού" διαφορετικών στελεχών "κοροναϊών".
-- Ένα αυθόρμητα μετασχηματισμένο παράγωγο της κυτταρικής σειράς BALB/c 3T3, με την ονομασία 17 Cl 1, και το παράγωγο L2 της κυτταρικής σειράς L929 αναπτύχθηκαν σε μέσο Dulbecco συμπληρωμένο με 10% μη θερμαινόμενο εμβρυϊκό ορό βοοειδών, πενικιλλίνη (100 U/ml) και στρεπτομυκίνη (100 ,ug/ml).
-- Το στέλεχος A59. του ιού της ηπατίτιδας ποντικού "virus" παράχθηκε σε κύτταρα 17 Cl 1
-- Οι µονοστρώσεις κυττάρων 17 Cl 1 σε γυάλινες κυλινδρικές φιάλες εµβολιάστηκαν µε τον "ιό" A59 σε πολλαπλότητα 1 έως 10 PFU/κύτταρο και µετά από περίοδο προσρόφησης 1 ώρας στους 37°C, προστέθηκαν σε κάθε κυλινδρική φιάλη 50 ml ελάχιστου απαραίτητου µέσου Eagle µε 10% µη θερµαινόµενο ορό βοοειδών και τα κύτταρα επωάστηκαν στους 37°C
-- Ο απελευθερωμένος "ιός" συλλέχθηκε συνήθως 24 έως 26 ώρες μετά τον εμβολιασμό, μετά από αρκετούς κύκλους μόλυνσης, όταν επιτυγχάνονταν υψηλές αποδόσεις και πολύ πριν από την εμφάνιση σημαντικών ποσοτήτων κυτταροπαθητικών αλλαγών, όπως η σύντηξη ή η λύση των κυττάρων (δηλ. δεν αναζητήθηκε η απαιτούμενη CPE/λύση για να διαπιστωθεί αν υπήρχε "ιός", καθώς θεωρήθηκε ότι υπήρχε)
-- Ο "ιός" καταβυθίστηκε με την προσθήκη 5,0 g NaCl ανά 150 ml διαυγασμένου υπερκείμενου υγρού, ακολουθούμενου από μισό όγκο 30% πολυαιθυλενογλυκόλης, ώστε να προκύψει τελική συγκέντρωση 10% πολυαιθυλενογλυκόλης και 2,2% NaCl.
-- Μετά από πολλαπλά στάδια φυγοκέντρησης με τη χρήση διαφόρων χημικών ουσιών, προστέθηκαν στο μέσο ραδιοσημασμένες ενώσεις σε τελική συγκέντρωση 2 έως 4 uCi μίγματος L-3H-αμινοξέων ή [5-3H]ουριδίνης ανά ml, 3 uCi [6-3H]φουκόζης ανά ml και 1 έως 4 uCi [35S]μεθειονίνης ανά ml.
-- Τα "καθαρισμένα ιόντα" από τρία ή λιγότερα μπουκάλια κυλίνδρων συνήθως σφαιροποιήθηκαν και επαναιωρήθηκαν σε 1 έως 2 ml ρυθμιστικού διαλύματος TMEN 6 στους 4°C.
-- Προστέθηκε NP40, που παραχωρήθηκε ευγενικά από την Shell, Inc., σε τελική συγκέντρωση 0,25 έως 1% και το μείγμα ανακινήθηκε έντονα με το χέρι τουλάχιστον 20 φορές.
-- Τα επεξεργασμένα με απορρυπαντικό "ιόντα" στρωματοποιήθηκαν στη συνέχεια στους 4°C πάνω σε βαθμίδες σακχαρόζης 15 έως 50% σε ρυθμιστικό διάλυμα TMEN 6 που περιέχει 0,1% NP40 ή στους 10°C πάνω σε βαθμίδες σακχαρόζης 30 έως 75% σε ρυθμιστικό διάλυμα TMEN 6 που περιέχει 0,1% NP40
-- Για τη διάσπαση των νουκλεοκαψιδικών συμπλόκων χρησιμοποιήθηκαν συνεχείς κλίσεις 20 έως 50% Renografin-76 που περιείχαν 0,1% NP40.
-- Για την ηλεκτροφόρηση σε πηκτή που χρησιμοποιήθηκε για το διαχωρισμό των πρωτεϊνών, κάθε φρεάτιο φορτώθηκε με περίπου 40 ul ραδιοσημασμένου δείγματος το οποίο είχε θερμανθεί στους 37°C για 15 λεπτά με ίσο όγκο μίγματος επεξεργασίας δείγματος αποτελούμενο από 6 M ουρία, 4% SDS, 0,05% μπλε της βρωμοφαινόλης σε 0,0625 M Tris-chloride, pH 6,7
-- Οι πηκτές εκτελέστηκαν στα 125 V για περίπου 4 ώρες υπό σταθερή τάση από τροφοδοτικό Savant.
-- Οι πηκτές εμποτίστηκαν με PPO (2,5-διφαινυλοξαζόλη, Sigma) σε διμεθυλοσουλφοξείδιο με τη μέθοδο των Bonner και Laskey, ξηράνθηκαν με ξηραντήρα πηκτής Savant σε χαρτί χρωματογραφίας Whatman αριθ. 17, εκτέθηκαν σε φιλμ Kodak XR-5 στους -70°C για 1 έως 4 εβδομάδες και αναπτύχθηκαν με χημικά της Kodak X-ray.
-- Ο "καθαρισµένος, συµπυκνωµένος ιός A59" διαλύθηκε µε 1% NP40 και καταψύχθηκε στους -75°C σε aliquots.
-- Μια ποσότητα 0,1 ml του παρασκευάσματος "ιού" εμβολιάστηκε με πλήρες επικουρικό Freund σε ποδοπέδιλα κουνελιών, ακολουθούμενη μετά από 2 εβδομάδες με μια δεύτερη έγχυση σε ποδοπέδιλα ενός επιπλέον 0,1 ml με ατελές επικουρικό Freund (Difco) και 1 εβδομάδα αργότερα με ενδοφλέβια έγχυση άλλων 0,4 ml επεξεργασμένου με απορρυπαντικό "ιού"
-- "Υπάρχουν δύο τύποι επικουρικού Freund: το πλήρες και το ατελές. Το πλήρες βοηθητικό του Freund ή CFA, είναι ένα γαλάκτωμα νερού σε λάδι, το οποίο περιέχει επίσης αδρανοποιημένα μυκοβακτηρίδια (πιο συχνά χρησιμοποιείται το Mycobacterium tuberculosis). Το ατελές βοηθητικό Freund's Adjuvant, ή IFA, είναι το ίδιο γαλάκτωμα νερού σε λάδι, αλλά δεν περιέχει το παθογόνο μυκοβακτηρίδιο." https://prosci-services.com/antibody-development-guide/freunds-adjuvant/.
-- Μετά την τρίτη ένεση, τα κουνέλια αιμορραγούσαν από το αυτί ανά διαστήματα 1 εβδομάδας για 1 μήνα
-- Για τα ανοσοκατακρημνίσματα των ραδιοσημασμένων "ιογενών" πολυπεπτιδίων, μια ποσότητα ορού κουνελιού 25 ul επωάστηκε με 25 έως 200 ul ραδιοσημασμένου δείγματος σε ρυθμισμένο με φωσφορικά άλατα φυσιολογικό ορό που περιείχε 0,1% NP40 στους 0°C για 1 ώρα
-- Τα σύμπλοκα αντιγόνου-αντισώματος και το αντίσωμα κατακρημνίστηκαν με περίσσεια καθαρισμένων, σταθεροποιημένων σε φορμαλίνη σταφυλόκοκκων (στέλεχος Cowan 1) για 10 λεπτά στους 4°C, σφαιροποιήθηκαν στις 3.000 rpm για 10 λεπτά, πλύθηκαν τρεις φορές σε 1 ml 0,05% NP40 με ρυθμισμένο με φωσφορικό άλας και στη συνέχεια διαλύθηκαν στο μίγμα επεξεργασίας του δείγματος με βρασμό για 1 λεπτό ή επεξεργασία στους 37°C για 15-30 λεπτά
Μην αισθάνεστε άσχημα αν μεγάλο μέρος της προηγούμενης περιγραφής σας "έστειλε αδιάβαστους", καθώς μοιράζεται για να δείξει τις πολυάριθμες διαδικασίες, χειρισμούς και μεταβολές που πρέπει να περάσει το δείγμα για να πάρει το επιθυμητό αποτέλεσμα
Στη μελέτη καθαρισμού του 1981, ο "ιός" ήταν και πάλι δημιούργημα της διαδικασίας κυτταροκαλλιέργειας:
-- Ο MHV3 καλλιεργήθηκε σε συρρέοντες δευτερογενείς εμβρυϊκούς ινοβλάστες ποντικού
-- Οι μονόλιθοι μολύνθηκαν με πολλαπλασιασμό εισόδου 0,1 μολυσματικών σωματιδίων ανά κύτταρο και μετά από περίοδο προσρόφησης 1,5 ώρας στους 37°C, επωάστηκαν για 72 ώρες στους 37°C σε MEM Eagle με 2% ορό εμβρύου μοσχαριού
-- Αποσπάσματα αυτού του εναιωρήματος "ιού" αποθηκεύτηκαν στους -70°C και χρησιμοποιήθηκαν για την παρασκευή σωματιδίων "καθαρισμένου ιού" και υποσυστατικών.
-- Ο "ιός" σφαιροποιήθηκε σε 75.000 × g για 1 ώρα και στη συνέχεια επαναιωρήθηκε σε 1 ml Dulbecco's phosphate buffered saline "A" (PBSA).
Στη µελέτη του 1983, ο "ιός" είναι ένα άλλο δηµιούργηµα κυτταρικής καλλιέργειας:
-- Ο "ιός" καλλιεργήθηκε στα κύτταρα της χοριοαλλαντικής μεμβράνης (CAM) απο-εμβρυοποιημένων αυγών κοτόπουλου
-- Αναφέρεται ότι υπάρχει λιγότερη συμφωνία σχετικά με τη σύνθεση της πρωτεΐνης S
-- Τα πιθανά πολυπεπτίδια S όλων των "κοροναϊών" που εξετάστηκαν λέγεται ότι έχουν mol. wt. μεγαλύτερο από εκείνο του πολυπεπτιδίου Ν.
-- Ο ραδιοσημασμένος IBV-M41 παρασκευάστηκε σε ζεύγη αποεμβρυοποιημένων αυγών- κάθε αυγό έλαβε 125 uCi [35S]μεθειονίνης (sp. act. > 800 Ci/mmol) ή [35S]μεθειονίνης συν 165 uCi μείγματος 15 αμινοξέων σημασμένων με 3Η.
-- Ο μη επισημασμένος "ιός" καλλιεργήθηκε σε παρτίδες 200 εμβρυακών αυγών ηλικίας 11 ημερών, τα οποία εμβολιάστηκαν με περίπου 3-5 log10 μέσης κυλιοστατικής δόσης50 του IBV-M41.
-- Μετά από φυγοκέντρηση, το σφαιρίδιο επαναιωρήθηκε σε ρυθμιστικό διάλυμα NET (100 mM- NaC1, 1 mM-EDTA, 10 mM-Tris-HCl pH 7,4) σε όγκο 20 ml και ηχογραφήθηκε στο μέγιστο πλάτος για 10 s με τον αισθητήρα 3 mm ενός διαλύτη υπερήχων MSE.
-- Οι μη επισημασμένοι δείκτες που χρησιμοποιήθηκαν ήταν η φωσφορυλάση b, η αλβουμίνη ορού βοοειδών και η καρβονική ανυδράση- κάποια φωσφορυλάση είχε προ-χρωματιστεί με Drimarine brilliant blue K-BL και το φαινόμενο mol. wt. ήταν 110K
-- Οι μελέτες αυτές λέγεται ότι έδειξαν ότι τα πεπλομερή του IBV αποτελούνται από δύο γλυκοπολυπεπτίδια των 90Κ και 84Κ σε ισομοριακή αναλογία, ενώ τα πολυπεπτίδια των 110Κ και 75Κ, που ανιχνεύονται μεταβλητά σε παρασκευάσματα "ιού", είναι πιθανώς πολυπεπτίδια του ξενιστή (με άλλα λόγια, δεν μπορούσαν να διαχωρίσουν το υλικό του ξενιστή)
Το 1985, έγινε μια μελέτη που προσπάθησε να καθαρίσει "ιούς" από κυτταρικές καλλιέργειες μέσω χρωματογραφίας συγγένειας:
-- Το στέλεχος Μ41 του IBV της Μασαχουσέτης καλλιεργήθηκε στις αλλαντοειδείς κοιλότητες εμβρυοποιημένων αυγών κοτόπουλου ηλικίας 11 ημερών και "καθαρίστηκε" σε ισοπυκνικές βαθμίδες σακχαρόζης, όπως περιγράφεται από τον Cavanagh (1981)
-- Ο "καθαρισμένος ιός" σφαιροποιήθηκε σε ρότορα 6 X 14 ml σε 70.000 X g για 3 ώρες στους 4°C και ανασυστάθηκε σε αλατούχο διάλυμα με φωσφορικά άλατα (PBS).
-- Προστέθηκε ίσος όγκος PBS που περιείχε 4% (wt./vol.) NP40, αναμίχθηκε με ομογενοποιητή Dounce και επωάστηκε για 2 ώρες στους 25°C.
-- Το ανοσοπροσροφητικό αποθηκεύτηκε σε PBS που περιείχε 0,2% NaN3 στους 4°C μέχρι να χρησιμοποιηθεί.
-- Πλύθηκε δύο φορές με 3 M NH4SCN σε PBS που περιείχε 0,1% οκτυλογλυκοζίτη, τέσσερις φορές με PBS και δύο φορές με PBS που περιείχε 2% NP40 πριν από τη χρήση.
-- Το διαλυμένο παρασκεύασμα "ιού" αναμίχθηκε με το ανοσοπροσροφητικό για 16 ώρες στους 4°C με τη χρήση περιστροφικού αναδευτήρα.
-- Το πήκτωμα χύθηκε σε στήλη χρωματογραφίας και πλύθηκε με PBS που περιέχει 0,1% NP40 (40 ml) και PBS που περιέχει 0,1% οκτυλογλυκοζίτη (10 ml).
-- προστέθηκαν 3 M NH,SCN σε PBS που περιέχει 0,1% οκτυλογλυκοζίτη και συλλέχθηκαν 10 κλάσματα του 1 ml
-- Τα κλάσµατα από την ηλεκτροφόρηση σε πηκτή που περιείχαν ανιχνεύσιµη "ιική" πρωτεΐνη συγκεντρώθηκαν και αποτέλεσαν το παρασκεύασµα της "καθαρισµένης" πρωτεΐνης.
-- Υπήρχαν και άλλες χρωματισμένες ζώνες, αλλά πρόκειται για τεχνουργήματα που παρατηρούνται μερικές φορές, ακόμη και απουσία πρωτεΐνης, με αυτή τη διαδικασία χρώσης
-- Η εργασία αυτή περιγράφει την εφαρμογή της χρωματογραφίας συγγένειας με χρήση μονοκλωνικών αντισωμάτων για τον "καθαρισμό" των δύο " ιϊκών" δομικών πρωτεϊνών που υπάρχουν στην επιφάνεια του "ιού" IB - ακίδα και μεμβράνη
-- Ο IBV διαλυτοποιήθηκε σε απορρυπαντικό NP40 και φυγοκεντρήθηκε σε βαθμίδα σακχαρόζης που περιείχε αυτό το απορρυπαντικό για τον "καθαρισμό" της πρωτεΐνης του νουκλεοκαψιδίου.
-- Η προσθήκη 1 Μ NaCI στα διαλύματα σακχαρόζης ήταν απαραίτητη για τον "καθαρισμό" των πρωτεϊνών της ακίδας και της μεμβράνης, καθώς συν-μεγαλοποιούνταν σε βαθμίδες που περιείχαν χαμηλές συγκεντρώσεις αλάτων.
-- Ωστόσο, η πρωτεΐνη του νουκλεοκαψιδίου δεν μπορούσε να καθαριστεί σε βαθμίδες που περιείχαν υψηλές συγκεντρώσεις αλάτων
-- Σε άλλες µελέτες (Cavanagh, 1984), το "καθαρισµένο" υλικό ακίδας περιείχε κάποια πρωτεΐνη νουκλεοκαψιδίου και το παρασκεύασµα µεµβράνης περιείχε άλλες πρωτεΐνες που θεωρήθηκε ότι ήταν κυτταρικής προέλευσης
-- Αναφέρεται ότι η χρήση χρωµατογραφίας συγγένειας έχει ορισµένα πλεονεκτήµατα και ότι µε την αξιοποίηση της ειδικότητας του αντισώµατος µπορεί να αποµονωθεί καθαρό υλικό, ακόµη και από ένα ακατέργαστο µείγµα πρωτεϊνών.
-- Με άλλα λόγια, χρησιμοποίησαν θεωρητικές οντότητες για να χρωματίσουν τις πρωτεΐνες και ισχυρίστηκαν ότι ήταν αυτές που ήθελαν μέσα από ένα ακατέργαστο μείγμα άλλων πρωτεϊνών... δηλαδή καθόλου καθαρισμένες/απομονωμένες
Στην πρώτη από τις δύο μελέτες του 1990, έχουμε πάλι έναν "ιό" που καλλιεργείται σε κύτταρα DBT, κύτταρα όγκου εγκεφάλου ποντικού που έχουν μετασχηματιστεί από τον "ιό" του σαρκώματος Rous:"
-- Το στέλεχος A59 του MHV (MHV-A59), που ελήφθη από την American Type Culture Collection, καθαρίστηκε δύο φορές με πλάκες και πέρασε τέσσερις φορές σε πολλαπλότητα μόλυνσης (MOl) O.Ol σε κύτταρα DBT
-- Ο "ιός" παρήχθη όπως περιγράφηκε προηγουμένως σε μέσο καλλιέργειας που περιείχε 1 % (v/v) FCS (εμβρυϊκός ορός μόσχου)
-- Τα κυτταρικά υπολείμματα σφαιροποιήθηκαν και ο "ιός" συμπυκνώθηκε με καταβύθιση με 10% (w/v) πολυαιθυλενογλυκόλη σε O.S M NaCl
-- Τα "ιικά" αντιγόνα ανασυγκροτήθηκαν και διαλυτοποιήθηκαν σε ρυθμιστικό διάλυμα TMEN (0,1 M Tris-acid-maleate, pH 6,2, 0,1 M NaC!, 1 mM EDTA) και διατηρήθηκαν στους -70°C μέχρι να χρησιμοποιηθούν.
-- Σε ορισµένα πειράµατα, ο "ιός" επισηµάνθηκε µε την προσθήκη 4 mCi [3SS]µεθειονίνης στο µέσο καλλιέργειας 6 ώρες µετά τη µόλυνση.
-- Για τη χρωματογραφία συγγένειας, ο συμπυκνωμένος "ιός" διαλυτοποιήθηκε με 2% (v/v) Nonidet P-40 (NP-40) για 2 ώρες σε θερμοκρασία δωματίου (RT) και οι διαλυτές πρωτεΐνες αναμίχθηκαν με την πηκτή 7-lOA-Sepharose και επωάστηκαν με την άκρη προς την άκρη για 16 ώρες στους 4°C
-- Η ειδικότητα της πηκτής προσδιορίστηκε με ανοσοπροσρόφηση ραδιοσημασμένου αντιγόνου, εκτεταμένη πλύση με 0,1% (v/v) NP-40 (σε ρυθμιστικό διάλυμα φωσφορικών 0,2 Μ, pH 6,2, 0,1 Μ NaC!, 1mM EDTA) και έκλουση των προσροφημένων πρωτεϊνών σε ρυθμιστικό διάλυμα δείγματος ηλεκτροφόρησης
-- Τα κλάσµατα που περιείχαν "καθαρισµένο" E2/S συγκεντρώθηκαν και χρησιµοποιήθηκαν για ανοσολογικές µελέτες.
-- Η γλυκοπρωτεΐνη E2/S που χρησιμοποιήθηκε για μελέτες ανοσογονικότητας "καθαρίστηκε" από "ιικά" αντιγόνα που συγκεντρώθηκαν από 1,8 λίτρα καλλιεργητικού μέσου από μολυσμένα με MHV -A59 κύτταρα DBT
-- Οι διμερείς και μονομερείς μορφές της E2/S "καθαρίστηκαν" χωρίς ανιχνεύσιμη επιμόλυνση από άλλες "ιικές" πρωτεΐνες, ωστόσο, παρατηρήθηκε αναπαραγώγιμα μια επιμόλυνση που ήταν πιθανώς κυτταρικής προέλευσης.
Στη δεύτερη μελέτη του 1990, το επίχρισμα μύτης από χοίρο αναπτύχθηκε σε κύτταρα MDCK από σκύλο:
-- Ο "καθαρισμένος" HEV επωάστηκε με 3H- DFP για 30 λεπτά στους 4°C και στη συνέχεια αναλύθηκε με ηλεκτροφόρηση σε πηκτή SDS-πολυακρυλαμιδίου
-- Μετά από χρώση με Coomassie Brilliant Blue έγιναν ορατές οι "ιικές" πρωτεΐνες N, M, S και HE
-- Προκειμένου να απομονωθεί η εστεράση του HEV από την "ιική" μεμβράνη, τα "καθαρισμένα ιόντα" υποβλήθηκαν σε επεξεργασία με 1% οκτυλογλυκοζίτη (OG)
-- Το νουκλεοκαψίδιο καθώς και η πρωτεΐνη Μ σφαιροποιήθηκαν με φυγοκέντρηση για 30 λεπτά στα 25.000 x g και οι γλυκοπρωτεΐνες που παρέμεναν στο υπερκείμενο (S και HE) φορτώθηκαν σε διαβάθμιση σακχαρόζης 10-30% σε PBS που περιείχε 1% OG
-- Μετά από φυγοκέντρηση στις 42.000 rpm για 16 ώρες σε ρότορα SW55, τα κλάσματα συλλέχθηκαν από τον πυθμένα του σωλήνα και αναλύθηκαν με ηλεκτροφόρηση σε πηκτή SDS-πολυακρυλαμιδίου.
-- Η S-πρωτεΐνη λέγεται ότι ανιχνεύθηκε στο κλάσμα 3, ενώ το μεγαλύτερο μέρος της HE ανακτήθηκε από το κλάσμα 6
Στην τελευταία µελέτη του 1991, ο BCV καλλιεργήθηκε και αναπτύχθηκε σε κύτταρα MDCK I, µια υποκατηγορία των κυττάρων του κυνικού νεφρού Madin-Darby:
-- Ο "ιός" συλλέχθηκε από το υπερκείμενο των μολυσμένων κυττάρων MDCK I 48 ώρες μετά τη μόλυνση.
-- Μετά τη διαύγαση του μέσου με φυγοκέντρηση χαμηλής ταχύτητας (2.000 x g, 10 λεπτά), ο "ιός" καθιζάνει με υπερφυγοκέντρηση στα 112.000 x g για 1 ώρα και το σφαιρίδιο επαναιωρείται σε αλατούχο διάλυμα ρυθμισμένου με φωσφορικά άλατα (PBS) και τοποθετείται σε βαθμίδα σακχαρόζης (5 έως 50% [wt/wt] σε PBS).
-- Μετά από φυγοκέντρηση στα 148.000 x g για 40 λεπτά, η υποτιθέμενη ζώνη "ιού" συλλέχθηκε, αραιώθηκε με PBS και καθιζάνονταν υπό τις ίδιες συνθήκες φυγοκέντρησης
-- Το σφαιρίδιο του "ιού" επαναιωρήθηκε σε PBS και χρησιμοποιήθηκε για τον καθαρισμό των γλυκοπρωτεϊνών του "ιού".
-- Οι "ιικές" γλυκοπρωτεΐνες απομονώθηκαν με κατεργασία με n-οκτυλογλυκοπυρανοσίδη και "καθαρίστηκαν" με φυγοκέντρηση με κλίση σακχαρόζης
-- Οι ερευνητές δηλώνουν ότι λόγω της αποτελεσματικότητας της πρωτεΐνης S στην αναγνώριση υποδοχέων που περιέχουν Neu5,9Ac2, είναι λογικό να υποθέσουμε ότι η πρωτογενής προσκόλληση αυτών των "κορονοϊών" διαμεσολαβείται από την πρωτεΐνη S και όχι από την HE
-- Το συμπέρασμα αυτό ήταν σύμφωνο με την ηλεκτρονική μικροσκοπική παρατήρηση των "ιικών" γλυκοπρωτεϊνών
-- Με άλλα λόγια, επειδή η πρωτεΐνη S λέγεται ότι είναι οι μεγαλύτερες αιχμές στις εικόνες ΗΜ, μπορεί να υποτεθεί ότι χρησιμοποιείται για την προσκόλληση στα κύτταρα για να τα μολύνει
-- Έτσι, κάθε φορά που ένα σωματίδιο "ιού" πλησιάζει ένα κύτταρο, οι κυτταρικοί υποδοχείς θα συναντήσουν πρώτα την πρωτεΐνη S
-- Από τα αποτελέσματα που παρουσιάστηκαν εδώ, πρότειναν ότι η προσκόλληση όλων των "κορονοϊών" στις κυτταρικές επιφάνειες διαμεσολαβείται από την πρωτεΐνη S ανεξάρτητα από τον τύπο των υποδοχέων που αναγνωρίζονται
Πόσο μακριά από την πραγματικότητα πρέπει να απομακρυνθεί μια ουσία για να καταστεί εντελώς ανούσια κάθε πληροφορία που λαμβάνεται από αυτήν; Στην περίπτωση οποιουδήποτε βιολογικού δείγματος, είναι η στιγμή που το υγρό αφαιρείται από τον ζωντανό οργανισμό προκειμένου να μελετηθεί σε ένα εργαστήριο υπό τεχνητές συνθήκες; Είναι η στιγμή που το δείγμα υποβάλλεται σε αφύσικες χημικές ουσίες που ισχυρίζονται ότι το κρατούν ζωντανό; Είναι η στιγμή που το δείγμα αναμιγνύεται με ξένα γενετικά υλικά από άλλα είδη με τα οποία δεν θα ερχόταν ποτέ σε επαφή μέσα στον ζωντανό οργανισμό; Είναι όταν το δείγμα υποβάλλεται σε αφύσικες δυνάμεις g που δεν θα συναντούσε ποτέ καθώς περιστρέφεται πολλές φορές μέσω υπερφυγοκέντρησης προκειμένου να διαχωριστούν τα συστατικά του; Είναι η στιγμή που το δείγμα σταθεροποιείται χημικά, αφυδατώνεται με αιθανόλη, χρωματίζεται με βαρέα μέταλλα, περικλείεται σε ρητίνη και εκτοξεύεται με ηλεκτρόνια; Ή μήπως είναι η στιγμή που το δείγμα προστίθεται σε μια πηκτή και δέχεται ηλεκτροπληξία για 4 ώρες μέχρι να ειπωθεί ότι τα σωματίδια διαχωρίζονται; Σε ποιο σημείο το βιολογικό δείγμα χάνει τον εαυτό του και δεν γίνεται τίποτα άλλο παρά μια εικόνα σε ένα βιβλίο;
Όσον αφορά τον "ιό" και τα υποτιθέμενα υποσυστήματά του, συμπεριλαμβανομένης της πρωτεΐνης S, τα αόρατα σωματίδια υπόκεινται σε πολυάριθμες διεργασίες που βλάπτουν και μεταβάλλουν το δείγμα με μη μετρήσιμους τρόπους. Αυτές περιλαμβάνουν μεταξύ άλλων:
Οι τεχνητές χημικές ουσίες και οι συνθήκες που συναντώνται κατά την καλλιέργεια των κυττάρων του υποτιθέμενου "ιού"
Οι αφύσικες δυνάμεις που εφαρμόζονται στο δείγμα κατά τη διάρκεια τυχόν διαδικασιών καθαρισμού
Οι διάφορες αλλοιώσεις που γίνονται κατά την προετοιμασία της ηλεκτρονικής μικροσκοπίας
Οι υψηλές τάσεις στις οποίες υποβάλλεται το δείγμα κατά την ηλεκτροφόρηση σε πηκτή
Αν δεν πιστεύετε ότι αυτές οι διαδικασίες θα βλάψουν και θα αλλοιώσουν το βιολογικό δείγμα με τον υποτιθέμενο "ιό" πέρα από κάθε αναγνώριση σε σημείο που να χάνει κάθε βιολογική σημασία, προφανώς δεν γνωρίζετε πώς λέγεται ότι το σαπούνι καταστρέφει τα σωματίδια του "ιού" και πρέπει να αφιερώσετε 2 λεπτά από τη μέρα σας για να παρακολουθήσετε το παρακάτω σύντομο κλιπ πατώντας ε δ ώ:
Τώρα που ξέρετε πώς το σαπούνι χεριών καταστρέφει εντελώς τον "ιό" από αυτό το όμορφα κινούμενο κλιπ, αναρωτηθείτε πώς ο "ιός" και τα επιμέρους συστατικά του, συμπεριλαμβανομένης της ακίδας πρωτεΐνης, υποτίθεται ότι επιβιώνουν από τον βομβαρδισμό προστιθέμενων χημικών ουσιών, ενώσεων, δυνάμεων κ.λπ. προκειμένου να μελετηθούν. Πώς τα υπολείμματα των σωματιδίων που απομένουν μετά από αυτές τις διαδικασίες έχουν κάποια σημασία για το τι συμβαίνει στο εσωτερικό ενός ζωντανού οργανισμού; Πώς μπορούν τα υποτιθέμενα "ιογενή" σωματίδια μέσα σε ένα μικτό δείγμα που περιέχει ξένο γενετικό υλικό από πολλές πηγές, το οποίο στη συνέχεια διασπάται σε πολλά μικρότερα αναμεμειγμένα σωματίδια του ίδιου μεγέθους, πυκνότητας και σχήματος, να ισχυριστούν ότι προέρχονται από την ίδια "ιογενή" πηγή;
Είναι 100% σίγουρο ότι οποιοσδήποτε ζωντανός οργανισμός δεν θα επιβίωνε ούτε θα παρέμενε στην ίδια κατάσταση στην οποία βρισκόταν αν περνούσε από παρόμοιες διαδικασίες στις οποίες υποβάλλονται αυτά τα "ιογενή" δείγματα. Μόλις το συνειδητοποιήσετε αυτό, και μόλις μάθετε ότι οι ερευνητές έχουν παραδεχτεί πολλές φορές ότι η τρέχουσα τεχνολογία όχι μόνο καταστρέφει τα υλικά, αλλά δεν μπορεί επίσης να καθαρίσει και να απομονώσει σωματίδια του ίδιου μεγέθους, σχήματος και πυκνότητας μακριά το ένα από το άλλο, γίνεται σαφές ότι οι όποιες πληροφορίες συλλέγονται από αυτούς τους βαριά τροποποιημένους και αναμεμειγμένους πληθυσμούς δεν έχουν καμία απολύτως σημασία. Στην καλύτερη περίπτωση, τα σωματίδια που δημιουργούνται χρησιμεύουν μόνο ως απεικόνιση. Ένα έργο διαστρεβλωμένης τέχνης που δημιουργήθηκε σε ένα εργαστήριο. Η εικόνα που χρησιμοποιείται για να πουλήσει την ιστορία, τον φόβο και το εμβόλιο. Ο "κορονοϊός" και η "ακίδα πρωτεΐνης" είναι απλώς οι τελευταίες μασκότ του μάρκετινγκ που χρησιμοποιήθηκαν με επιτυχία για μια ακόμη κερδοφόρα εκστρατεία φόβου.
Αν σας άρεσε αυτό το άρθρο, μοιραστείτε το με την οικογένεια, τους φίλους και τους συναδέλφους σας, εγγραφείτε για να λαμβάνετε περισσότερο περιεχόμενο και αν θέλετε να στηρίξετε το συνεχές έργο μου, μπορείτε να χρησιμοποιήσετε τον παρακάτω σύνδεσμο.
Παρακαλώ βοηθήστε να στηρίξετε το έργο μου. 🙏
---Δικτυογραφία :
The Spike Protein – ViroLIEgy
https://viroliegy.com/2022/07/12/the-spike-protein/