Rosemary Frei, MSc: “Το Δηλητηριώδες Χάπι της Pfizer για το Covid”
Μετάφραση: Απολλόδωρος
26 Ιανουαρίου 2022 | Rosemary Frei, MSc | Διαβάστε το εδώ.
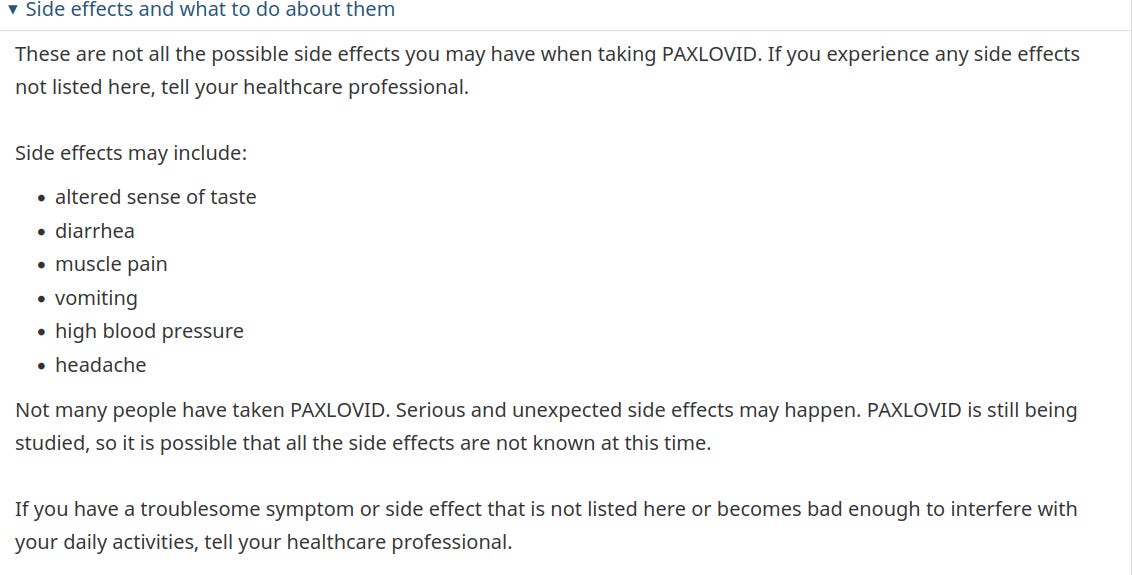
Το Paxlovid της Pfizer κυκλοφορεί σε όλο τον κόσμο. Αλλά κατά κάποιο τρόπο είναι ακόμη πιο πειραματικό από την ένεση Covid της φαρμακευτικής εταιρείας. Για παράδειγμα, η Health Canada - η οποία, όπως και ο FDA των ΗΠΑ, είναι επί δεκαετίες σύμμαχος της φαρμακοβιομηχανίας - παραδέχεται ότι: "Δεν έχουν πάρει πολλοί άνθρωποι το Paxlovid. Μπορεί να συμβούν σοβαρές και απροσδόκητες παρενέργειες".
Οι γιγαντιαίες αυτοκινητοπομπές φορτηγών κυλούν προς την Οττάβα, συνοδευόμενες από υποστηρικτές από τοίχο σε τοίχο και κάλυψη από τα μέσα μαζικής ενημέρωσης.
Την ίδια στιγμή όμως, το Paxlovid της Pfizer αρχίζει να κυκλοφορεί σχετικά αθόρυβα σε όλη τη Βόρεια Αμερική, την Ευρώπη, το Ηνωμένο Βασίλειο και πέρα από αυτό.
Πρόκειται για ένα σετ χαπιών για το Covid - και είναι το δεύτερο μέρος ενός διπλού “χτυπήματος” που ξεκίνησε με την ένεση mRNA Covid της εταιρείας.
Μαζί, τροφοδοτούν την Pfizer σε ιλιγγιώδη επίπεδα κερδών και κεφαλαιοποίησης της αγοράς.
Όμως, είναι ελάχιστα έως καθόλου πιθανό να προκύψει "pax" (η λατινική λέξη για την ειρήνη) από αυτά τα χάπια.
Το Paxlovid έχει δοκιμαστεί σε πολύ λίγους ανθρώπους μέχρι στιγμής. Δεν έχει μελετηθεί καθόλου σε εμβολιασμένους ανθρώπους ή σε εκείνους που έχουν πάρει το Covid. Τα χάπια αλληλεπιδρούν αρνητικά με πολλά πολύ ευρέως χρησιμοποιούμενα φάρμακα. Πλέον φυσικά οι μελέτες χειραγωγούνται για να παράγουν φαινομενικά καλά αποτελέσματα.
Έχω ακούσει ότι στο παρασκήνιο κάποιοι υπάλληλοι των ρυθμιστικών οργανισμών έχουν βαρεθεί να υποκύπτουν στις έντονες πιέσεις των πολιτικών, των αξιωματούχων δημόσιας υγείας και των μεγάλων φαρμακευτικών εταιρειών. Δεν θέλουν τα μέλη του κοινού να παίρνουν αυτό το εξαιρετικά ανεπαρκώς μελετημένο και δυνητικά πολύ επικίνδυνο σύνολο χαπιών.
Κάθε δόση του Paxlovid αποτελείται από ένα χάπι ριτοναβίρης - ένα επαναχρησιμοποιημένο παλιό φάρμακο για τον HIV - και δύο χάπια ενός νέου φαρμάκου που ονομάζεται νιρματρέλβιρη. Και τα δύο αυτά φάρμακα είναι αναστολείς της πρωτεάσης.
Αυτός ο συνδυασμός νιρματρελβίρης/ριτοναβίρης εγκρίθηκε για χρήση στις ΗΠΑ από τον Οργανισμό Τροφίμων και Φαρμάκων στο πλαίσιο Άδειας Έκτακτης Χρήσης (EUA) στις 22 Δεκεμβρίου 2021 και για χρήση στον Καναδά από τον Οργανισμό Υγείας του Καναδά στις 17 Ιανουαρίου 2022.
Και ταχέως εγκρίνεται και αλλού: για παράδειγμα, έλαβε έγκριση στο Ισραήλ στις 26 Δεκεμβρίου 2021, στη Νότια Κορέα στις 27 Δεκεμβρίου 2021, στο Ηνωμένο Βασίλειο στις 31 Δεκεμβρίου 2021 και στη Γαλλία στις 21 Ιανουαρίου 2022.
Επιτρέπεται σε νέους - 12 ετών και άνω - και ενήλικες στις ΗΠΑ, το Ισραήλ και τη Νότια Κορέα. Σε άλλες χώρες, συμπεριλαμβανομένων του Ηνωμένου Βασιλείου και του Καναδά, επιτρέπεται για άτομα 18 ετών και άνω.
(Σημειώστε ότι η έγκριση δεν είναι έγκριση- είναι πολύ γρήγορη αξιολόγηση που ακολουθείται από το νεύμα για να επιτραπεί σε δεκάδες εκατομμύρια ανθρώπους να το πάρουν, επειδή υποτίθεται ότι βρισκόμαστε σε μια πρωτοφανή κρίση δημόσιας υγείας που μοιάζει με πόλεμο).
Επίσης, μια δοκιμή σε ένα τρυβλίο petri από επιστήμονες της Pfizer έδειξε ότι μπορεί να έχει κάποια επίδραση στο Omicron - δείτε την πρώτη παράγραφο στη σελίδα 36 του καναδικού δελτίου προδιαγραφών (ή αλλιώς μονογραφία προϊόντος) της 22ας Ιανουαρίου σχετικά με αυτό. Με βάση αυτά τα πολύ λεπτά στοιχεία, τα κυρίαρχα μέσα ενημέρωσης αναφέρουν ευρέως ότι "τα χάπια αναμένεται να είναι αποτελεσματικά κατά του Omicron".
Τα χάπια νιρματρελβίρης/ριτοναβίρης εγκρίνονται για χρήση από άτομα που έχουν θετικό τεστ για το Covid, έχουν ήπια ή μέτρια συμπτώματα και θεωρούνται ότι "διατρέχουν υψηλό κίνδυνο εξέλιξης σε σοβαρό COVID-19".
Αλλά πώς ορίζει η Pfizer τον υψηλό κίνδυνο;
Όντας 60 ετών και άνω. Ή υπέρβαροι. Ή να έχεις υψηλή αρτηριακή πίεση. Ή μια σειρά από άλλα πράγματα - συμπεριλαμβανομένης της ύπαρξης "άλλων παθήσεων ή παραγόντων (π.χ. φυλή ή εθνικότητα) που μπορεί να θέτουν τους ασθενείς σε υψηλό κίνδυνο εξέλιξης". (Βλέπε σελίδα 8 του καναδικού δελτίου προδιαγραφών της 22ας Ιανουαρίου).
Αυτός είναι ένας εξαιρετικά ευρύς ορισμός.
Ένα άλλο ανησυχητικό γεγονός είναι ότι οι αποφάσεις των ΗΠΑ και του Καναδά να εγκρίνουν τη νιρματρελβίρη/ριτοναβίρη βασίστηκαν μόνο σε ενδιάμεσες αναλύσεις μιας εν εξελίξει μελέτης. Η μελέτη αυτή ξεκίνησε στις 25 Αυγούστου 2021 και έχει προγραμματιστεί να ολοκληρωθεί περίπου στις 24 Απριλίου 2022.
Συνολικά μόνο περίπου 1.000 άτομα είχαν τυχαιοποιηθεί για να λάβουν νιρματρελβίρη/ριτοναβίρη κατά τη στιγμή που οι αμερικανικές και καναδικές αρχές έδωσαν το "μπράβο, προχωρήστε".
(Είναι πολύ δύσκολο να αποκρυπτογραφήσει κανείς ποιοι είναι οι συγκεκριμένοι αριθμοί - τόσο το δελτίο τύπου της Pfizer της 5ης Νοεμβρίου 2021 που περιγράφει την ενδιάμεση ανάλυση που εξετάστηκε από τον FDA όσο και η καναδική μονογραφία προϊόντος της 17ης Ιανουαρίου 2022 - η οποία έχει μια ενδιάμεση ανάλυση από λίγο μεταγενέστερη ημερομηνία - έχουν ένα εύρος αριθμών, καθώς και διάφορους τύπους αναλύσεων δεδομένων).
Επιπλέον, μόνο το 13% αυτού του μικρού αριθμού ήταν άτομα ηλικίας 65 ετών και άνω και μόλις το 3% ήταν 75 ετών και άνω. (Βλέπε ενότητα 1.2, με τίτλο "Γηριατρική", στη σελίδα 4 της καναδικής μονογραφίας προϊόντος για το Paxlovid της 17ης Ιανουαρίου 2022).
Πλέον, ακόμη και αυτά τα ενδιάμεσα αποτελέσματα χειραγωγήθηκαν στο έπακρο στη συγγραφή της μελέτης (περισσότερα σχετικά με αυτό παρακάτω) - η οποία στην περίπτωση των ΗΠΑ ήταν απλώς ένα δελτίο ειδήσεων της Pfizer της 5ης Νοεμβρίου 2021.
Και η Pfizer δεν έδωσε καν στη δημοσιότητα τα αρχικά δεδομένα που παρείχε στην Health Canada, απ' όσο μπορώ να διαπιστώσω. Επιπλέον, το δελτίο ειδήσεων της εταιρείας της 17ης Ιανουαρίου 2022, με το οποίο ανακοινώθηκε η έγκριση στον Καναδά, περιείχε πολύ λίγες λεπτομέρειες.
Ήταν όλα πολύ προβλέψιμα.
Αυτό είναι προφανές από το γεγονός ότι περισσότερο από ένα μήνα πριν από την έγκριση του FDA -- στις 18 Νοεμβρίου 2021 -- η κυβέρνηση των ΗΠΑ υπέγραψε μια συμφωνία ύψους 5,3 δισεκατομμυρίων δολαρίων για 10 εκατομμύρια κύκλους μαθημάτων νιρματρελβίρης/ριτοναβίρης (δηλαδή 530 δολάρια ΗΠΑ ανά κύκλο μαθημάτων), εν αναμονή της έγκρισης του FDA.
Το ίδιο και στον Καναδά: στις 3 Δεκεμβρίου 2021, η καναδική κυβέρνηση ανακοίνωσε τη δέσμευσή της να αγοράσει ένα αρχικό εκατομμύριο σειρές μαθημάτων νιρματρελβίρης/ριτοναβίρης από την Pfizer, εν αναμονή της έγκρισης από τον Καναδά. Αυτό αξίζει περίπου 690 εκατομμύρια δολάρια (καναδικά δολάρια) όταν κάνετε τους υπολογισμούς με βάση τα 530 δολάρια ΗΠΑ ανά μάθημα και τη συναλλαγματική ισοτιμία 1,3. (Ένας “κύκλος" σημαίνει ο συνολικός αριθμός των δόσεων που απαιτούνται για την ολοκλήρωση ενός θεραπευτικού σχήματος).
(Η ίδια ανακοίνωση ανέφερε ότι η καναδική κυβέρνηση είχε επίσης υπογράψει συμφωνία με τη Merck για την αγορά 500.000 “κύκλων” του χαπιού Covid της Merck, molnupiravir - με επιλογές για την αγορά 500.000 ακόμη μαθημάτων - επίσης εν αναμονή της έγκρισης του Health Canada.) (Το molnupiravir εγκρίθηκε από το FDA των ΗΠΑ λίγο αργότερα, στις 23 Δεκεμβρίου 2021, παρά τις σημαντικές ανησυχίες. Αυτές περιλαμβάνουν τη χαμηλή αποτελεσματικότητα, την υψηλή τοξικότητα και το ενδεχόμενο οι γυναίκες που το λαμβάνουν κατά τη διάρκεια της εγκυμοσύνης να γεννήσουν παιδιά με γενετικές ανωμαλίες. Ο FDA εξουσιοδότησε τη Merck να το πωλεί για άτομα ηλικίας 18 ετών και άνω με ήπιο έως μέτριο Covid που έχουν θετικό τεστ και διατρέχουν "υψηλό κίνδυνο" να αναπτύξουν σοβαρό Covid. Η Health Canada δεν έχει δώσει ακόμη την έγκριση. Και τα μέσα μαζικής ενημέρωσης αναφέρουν ότι και άλλες χώρες έχουν αρχίσει να έχουν δεύτερες σκέψεις σχετικά με αυτό).
Υπάρχουν κι άλλα. Για παράδειγμα, το nirmatrelvir/ritonavir δεν έχει δοκιμαστεί καθόλου σε άτομα που έχουν εμβολιαστεί και/ή έχουν πάθει Covid. Παρά το γεγονός αυτό, είναι μεταξύ των ανθρώπων που οι αξιωματούχοι θέλουν πρώτοι στη σειρά για αυτό. [διορθώθηκε στις 28 Ιανουαρίου - στο πρωτότυπο είχα γράψει κατά λάθος "δεν έχουν εμβολιαστεί ή/και δεν έχουν πάρει Covid"].
Επίσης, δεν δοκιμάζεται καθόλου σε έγκυες ή θηλάζουσες γυναίκες.
Η Pfizer αναφέρει στη σελίδα 12 της μονογραφίας του προϊόντος ότι το Paxlovid "δεν πρέπει να χρησιμοποιείται σε έγκυες γυναίκες, εκτός εάν τα πιθανά οφέλη υπερτερούν των πιθανών κινδύνων για το έμβρυο".
Αλλά δεν υπάρχει καμία τέτοια προειδοποίηση για τη χρήση της νιρματρελβίρης/ριτοναβίρης από γυναίκες που θηλάζουν.
Όπως σημείωσα νωρίτερα σε αυτό το άρθρο, κάθε δόση του Paxlovid αποτελείται από δύο δισκία νιρμαλτρελβίρης και ένα δισκίο ριτοναβίρης. Κάθε σετ των τριών δισκίων πρέπει να λαμβάνεται δύο φορές την ημέρα για πέντε ημέρες, ξεκινώντας εντός πέντε ημερών από την έναρξη των συμπτωμάτων.
Η ριτοναβίρη χρησιμοποιείται από το 1996 σε άτομα που έχουν θετικό τεστ για HIV. Είναι ευρέως γνωστό ότι προκαλεί σοβαρές, απειλητικές για τη ζωή καταστάσεις όπως παγκρεατίτιδα, προβλήματα καρδιακού ρυθμού, ηπατικά προβλήματα, σοβαρό δερματικό εξάνθημα και αλλεργικές αντιδράσεις.
Ωστόσο, η νιρματρελβίρη/ριτοναβίρη δεν έχει μελετηθεί σε άτομα με έκπτωση της ηπατικής λειτουργίας. Και ούτε η Pfizer ούτε οι κυβερνητικοί αξιωματούχοι προειδοποιούν ότι το nirmatrelvir/ritonavir δεν πρέπει να λαμβάνεται, για παράδειγμα, από άτομα που διατρέχουν κίνδυνο ανάπτυξης μη φυσιολογικής ηπατικής λειτουργίας (συμπεριλαμβανομένων εκείνων που είχαν ηπατίτιδα Β, ηπατίτιδα C ή αυξημένα αποτελέσματα στις εξετάσεις ηπατικής λειτουργίας).
Αντίθετα, βάζουν στην πρώτη γραμμή τους εύθραυστους, τους ηλικιωμένους ή/και όσους ζουν σε συνθήκες φτώχειας ή βρίσκονται σε άλλη μειονεκτική θέση.
Για παράδειγμα, ένα άρθρο του CBC News της 25ης Ιανουαρίου αναφέρει ότι ο αναπληρωτής επικεφαλής της δημόσιας υγείας του Καναδά, Howard Njoo, συνιστά οι πρώτοι που θα λάβουν τα χάπια να είναι "οι άνθρωποι που είναι ανοσοκατεσταλμένοι, 80 ετών και άνω, ή [εκείνοι] που μπορεί να μην έχουν πρόσβαση στην υγειονομική περίθαλψη λόγω γεωγραφικών ή κοινωνικοοικονομικών προβλημάτων[,] είναι πρώτοι στη σειρά - ανεξάρτητα από την κατάσταση εμβολιασμού". [Η υπογράμμιση προστέθηκε από εμένα.]
Το Κεμπέκ είναι ένα από τα πρώτα μέρη που είναι έτοιμο να αρχίσει να το χρησιμοποιεί σε αυτά τα ευάλωτα άτομα. Μέχρι τον Μάρτιο αναμένεται να λάβουν αρκετά από τα χάπια για να θεραπεύσουν περισσότερα από 25.000 άτομα. Αυτό περιλαμβάνει εκείνους με "σοβαρές παθήσεις που δεν μπορούν να εμβολιαστούν". Μετά από αυτό, θα ανοίξουν την ουρά για άλλους.
Ως εκ τούτου, φαίνεται ότι οι πολιτικοί, οι κυβερνητικοί αξιωματούχοι και η Pfizer υποδαυλίζουν τη ζήτηση χρησιμοποιώντας το ίδιο εγχειρίδιο που έκαναν και με τα εμβόλια.
Διαθέτουν αρχικά μόνο έναν σχετικά μικρό αριθμό χαπιών.
Και τα κυρίαρχα μέσα μαζικής ενημέρωσης βοηθούν να το διαφημίσουν. Για παράδειγμα, ένα μόνο ρεπορτάζ του CBC -- από τη δημοσιογράφο του Μόντρεαλ Verity Stevenson στις 18 Ιανουαρίου -- το αποκάλεσε "περιζήτητο" φάρμακο που έχει "επαινεθεί για τη δυνατότητά του να μειώσει τις νοσηλείες από τον ιό" μέσω της αναφοράς της Pfizer ότι "το Paxlovid μείωσε τον κίνδυνο νοσηλείας ή θανάτου κατά εντυπωσιακό 89% σε σύγκριση με το εικονικό φάρμακο".
Και εδώ είναι ένα άλλο παράδειγμα της συνολικής πολύ θετικής κάλυψης- είναι στη σημερινή Toronto Star.
Ένα άρθρο της National Post της 25ης Ιανουαρίου 2022 αποτελεί κάποια εξαίρεση: ο συγγραφέας, Tom Blackwell, επισημαίνει το πρόβλημα της παρεμβολής του Paxlovid στις επιδράσεις άλλων φαρμάκων (περισσότερα σχετικά με αυτό παρακάτω). Ωστόσο, δεν αναφέρει τα περισσότερα από τα άλλα σημαντικά μειονεκτήματα των χαπιών.
Ωστόσο, ακόμη και η καναδική ομοσπονδιακή κυβέρνηση παραδέχεται, στην ιστοσελίδα της για το ευρύ κοινό σχετικά με το χάπι, ότι "Δεν έχουν πάρει πολλοί άνθρωποι το Paxlovid. Μπορεί να συμβούν σοβαρές και απροσδόκητες παρενέργειες. Το Paxlovid βρίσκεται ακόμη υπό μελέτη, οπότε είναι πιθανό να μην είναι γνωστές όλες οι παρενέργειες προς το παρόν". [Η υπογράμμιση προστέθηκε από εμένα.]
Πιο κάτω στην ίδια σελίδα, λέει ότι οι άνθρωποι πρέπει να αναφέρουν οποιεσδήποτε υποψίες για παρενέργειες απευθείας στον Καναδά Υγείας.
Δυστυχώς, ωστόσο, γνωρίζουμε από την τεράστια υπο-αναφορά σοβαρών επιπτώσεων και θανάτων από, για παράδειγμα, τα εμβόλια Covid, ότι είναι εξαιρετικά απίθανο οι ομοσπονδιακοί να καταγράψουν πιστά και να εμφανίσουν δημοσίως όλες αυτές τις αναφορές.
Από την πλευρά του, ο FDA ζήτησε από την Pfizer να του αναφέρει τις "σοβαρές ανεπιθύμητες ενέργειες και όλα τα φαρμακευτικά σφάλματα που σχετίζονται με τη χρήση του Paxlovid", ως μέρος της EUA. Επίσης, όρισε ότι οι εγκαταστάσεις υγειονομικής περίθαλψης και οι πάροχοι υγειονομικής περίθαλψης που λαμβάνουν το Paxlovid θα παρακολουθούν και θα αναφέρουν τα σοβαρά ανεπιθύμητα συμβάντα και τα σφάλματα φαρμακευτικής αγωγής. Ωστόσο, και αυτό είναι πολύ απίθανο να οδηγήσει σε πλήρη και ειλικρινή δημόσια αναφορά.
(Ο FDA ζήτησε επίσης από την εταιρεία να παράσχει στον FDA περαιτέρω αποτελέσματα της δοκιμής σχετικά με την ασφάλεια και την αποτελεσματικότητα μέχρι την ολοκλήρωση της μελέτης τον Απρίλιο).
Έτσι, δεν προσπαθούν καν να προσποιηθούν ότι έχει αποδειχθεί ότι είναι ασφαλές και αποτελεσματικό.
Εξάλλου, αυτή είναι η φαρμακο-λογική εποχή της ιστορίας του πλανήτη μας.
Ακολουθούν τρεις ακόμη κόκκινες σημαίες μεταξύ των πολλών που περιβάλλουν το Paxlovid:
1. Ο FDA των ΗΠΑ παρέλειψε το σημαντικό βήμα να λάβει πληροφορίες από μια συμβουλευτική ομάδα προτού χορηγήσει άδεια επείγουσας χρήσης στο Paxlovid.
Αυτή η επιτροπή ονομάζεται Συμβουλευτική Επιτροπή Αντιμικροβιακών Φαρμάκων. Τα μέλη της επιτροπής εξετάζουν προσεκτικά τα δεδομένα των φαρμακευτικών εταιρειών για τα φάρμακα των εταιρειών που ζητούν έγκριση. Οι συνεδριάσεις της επιτροπής είναι δημόσιες και τις παρακολουθούν ΜΜΕ και άλλοι.
(Αντίθετα, στην περίπτωση της molnupiravir συγκαλείται, στα τέλη Νοεμβρίου 2021 [τα μέλη ψήφισαν υπέρ, 13 έναντι 10. Στη συνέχεια, στις 23 Δεκεμβρίου 2021, ο FDA την ενέκρινε]).
Το ανακάλυψα αυτό όταν έπεσα πάνω σε ένα άρθρο του SonsOfLibertyMedia.com στις 6 Ιανουαρίου 2022 σχετικά με το Paxlovid. Το άρθρο περιγράφει, μεταξύ πολλών άλλων διορατικών πληροφοριών, ένα άρθρο του Bloomberg Law της 22ας Δεκεμβρίου 2021, σχετικά με τη διαμάχη που προκλήθηκε από την παράλειψη του σημαντικού αυτού βήματος από τον FDA.
Η συνεδρίαση της επιτροπής είναι συνήθως απλώς μια σφραγίδα από καουτσούκ, αλλά παρ' όλα αυτά η παράλειψή της είναι πολύ ασυνήθιστη.
2. Εκτός από αναστολέας της πρωτεάσης, η ριτοναβίρη μειώνει τη δραστηριότητα ενός εξαιρετικά σημαντικού ενζύμου που ονομάζεται CYP3A4. Το CYP3A4 παράγεται στο ήπαρ. Εκεί, έχει κεντρική σημασία για τον μεταβολισμό (δηλαδή τη διάσπαση) ενός μεγάλου αριθμού φαρμάκων και τοξινών- αυτό είναι απαραίτητο πριν τα φάρμακα και οι τοξίνες μπορέσουν να απομακρυνθούν από το σώμα.
Δεδομένου ότι η ριτοναβίρη (και κατ' επέκταση το Paxlovid) μειώνει τη δραστηριότητα του CYP3A4, αυτό σημαίνει ότι αυτός ο μεγάλος αριθμός φαρμάκων και τοξινών θα παραμείνει στο σώμα περισσότερο.
Η ιστοσελίδα της καναδικής ομοσπονδιακής κυβέρνησης για το Paxlovid παραδέχεται ότι "πολλά φάρμακα αλληλεπιδρούν με το Paxlovid. Η λήψη του Paxlovid με αυτά τα φάρμακα μπορεί να προκαλέσει σοβαρές ή απειλητικές για τη ζωή παρενέργειες". [Η υπογράμμιση προστέθηκε από εμένα.]
Συνολικά, υπάρχουν περισσότερα από 100 φάρμακα που η Pfizer λέει ότι δεν πρέπει να λαμβάνονται με το Paxlovid. Σε αυτά περιλαμβάνονται πολύ ευρέως χρησιμοποιούμενα όπως η λιδοκαΐνη, η βαρφαρίνη, η φαινοβαρβιτάλη, η ερυθρομυκίνη, το βαλσαμόχορτο, η φαιντανύλη, η μεθαδόνη, η μιδαζολάμη και η πρεδνιζόνη.
3. Τα αποτελέσματα της μελέτης στο δελτίο Τύπου της Pfizer U.S. 5 Νοεμβρίου 2021, στηρίχθηκαν σε στατιστικές αναλύσεις "πρόθεσης-προς-θεραπεία". Αυτές δεν είναι καθόλου αυστηρές.
Αν αναζητήσετε τι σημαίνει "πρόθεση-προς-μεταχείριση", θα δείτε ότι βασίζεται στην υπόθεση ότι τα υποκείμενα της μελέτης έλαβαν τη θεραπεία, είτε την έλαβαν στην πραγματικότητα είτε όχι. Πολλά άρθρα σχετικά με αυτή την προσέγγιση δηλώνουν ότι είναι σταθερή. Αλλά αντικειμενικά δεν είναι καθόλου. (Άρχισα να παρατηρώ τις αναλύσεις intent-to-treat σε ιατρικές ερευνητικές μελέτες πριν από τουλάχιστον 20 χρόνια. Ήταν - και εξακολουθεί να είναι, εξ όσων γνωρίζω - ένας δημοφιλής τρόπος για να αποφεύγεται η ειλικρινής αναφορά των αποτελεσμάτων και της αποτελεσματικότητας των φαρμάκων που δοκιμάζονται).
Και για να είμαστε σαφείς, η μελέτη της Pfizer για την κυκλοφορία των ειδήσεων δεν σταμάτησε εκεί - οι αναλύσεις πρόθεσης-προς-μεταχείριση χρησιμοποιούν μια "τροποποιημένη" προσέγγιση. Συγκεκριμένα, περιλαμβάνουν, για παράδειγμα, άτομα "τα οποία κατά την έναρξη της μελέτης δεν έλαβαν ούτε αναμενόταν να λάβουν θεραπευτική αγωγή με COVID-19 mAb [μονοκλωνικό αντίσωμα]".
Δεν μπορεί να τα χωρέσει το μυαλό σας αυτά τα πράγματα.
Ελπίζω ειλικρινά ότι οι εργαζόμενοι που, στο παρασκήνιο, αντιστέκονται στην πίεση να επιτραπεί η χορήγηση του Paxlovid σε πολλούς ανθρώπους, θα κερδίσουν την μάχη.
Αποχαιρετισμός στην Ιολογία - Έκθεση Eμπειρογνώμονα (Expert Edition)
Μετάφραση: Απολλόδωρος 15 Σεπτεμβρίου 2022 | Dr. Mark Bailey Διαβάστε το εδώThanks for reading Apollodoros’s Newsletter! Subscribe for free to receive new posts and support my work.
Υπάρχουν Aυτοί Που ΜΠΟΡΟΥΝ Nα Eξηγήσουν Tι Kάνουν οι ιολόγοι και Yπάρχουν και Aυτοί Που ΔΕΝ ΜΠΟΡΟΥΝ :-). 🙂 [BINTEO]
Μετάφραση: Απολλόδωρος 1 Φεβρουαρίου 2024 | Dr.Mark Bailey, Steve Falconer | Διαβάστε το εδώ.
---Δικτυογραφία:
Pfizer's Poison Covid Pill - Rosemary Frei
https://www.rosemaryfrei.ca/pfizers-covid-poison-pill/










![Υπάρχουν Aυτοί Που ΜΠΟΡΟΥΝ Nα Eξηγήσουν Tι Kάνουν οι ιολόγοι και Yπάρχουν και Aυτοί Που ΔΕΝ ΜΠΟΡΟΥΝ :-). 🙂 [BINTEO]](https://substackcdn.com/image/fetch/$s_!CsQ0!,w_1300,h_650,c_fill,f_auto,q_auto:good,fl_progressive:steep,g_auto/https%3A%2F%2Fsubstack-video.s3.amazonaws.com%2Fvideo_upload%2Fpost%2F141459221%2F292fb005-0806-48c2-90fa-10ce60b14560%2Ftranscoded-08115.png)