ΦΑΚΕΛΛΟΣ ΙΟΛΟΓΙΑ: Τα Αντισώματα™
Ακολουθεί η εμπορική ετικέτα εδώ.
Μετάφραση: Απολλόδωρος
13 Ιανουαρίου 2023 | Mike Stone | Διαβάστε το εδώ.
Μπορείτε να κάνετε εφάπαξ ή επαναλαμβανόμενες δωρεές μέσω του Ko-Fi:
«Θα ήταν παράλογο να φανταστεί κανείς ότι τα μηχανικά διαγράμματα έχουν οποιαδήποτε αναπαράσταση στον κόσμο των γεγονότων. Είναι αποκυήματα της φαντασίας και μπορεί να εξυπηρετούν κάποιο χρήσιμο σκοπό, όπως τα βιβλία με εικόνες εξυπηρετούν στη διδασκαλία του αλφαβήτου σε ένα παιδί».
Henry Smith Williams και James Beveridge στο βιβλίο του 1915 The Mechanism of Immunization (Ο μηχανισμός της ανοσοποίησης)
Όταν αρχικά, τον Απρίλιο του 2021, άρχισα να ξεψαχνίζω την ιστορία της έρευνας για τα «αντισώματα», έψαχνα κυρίως για δύο βασικά στοιχεία: πρώτον, ήθελα να δω αν οι ερευνητές είχαν ποτέ αποδείξει ότι είχαν καθαρίσει και απομονώσει τα λεγόμενα «αντισώματα» απευθείας από τον ορό ενός ξενιστή και είχαν χαρακτηρίσει πλήρως αυτές τις οντότητες. Δεύτερον, ήθελα να δω αν είχαν πάρει ποτέ αυτές τις καθαρισμένες και απομονωμένες οντότητες και είχαν αποδείξει πειραματικά ότι, εκθέτοντάς τες σε δείγμα που περιείχε έναν καθαρισμένο και απομονωμένο παθογόνο «ιό», αυτό είχε πράγματι ως αποτέλεσμα τα υποτιθέμενα αποτελέσματα της προσκόλλησης των «αντισωμάτων» στον «ιό» και τελικά την εξάλειψή του. Δεδομένου ότι γνώριζα μέσω της προηγούμενης έρευνάς μου ότι η εύρεση καθαρισμένων και απομονωμένων «ιών» ήταν αδύνατη, προέβλεψα ότι η εύρεση των αποδείξεων που αναζητούσα για τα πολύ μικρότερα «αντισώματα» θα ήταν μάλλον δύσκολη υπόθεση. Ανεξάρτητα από αυτό, αν οι ερευνητές ήταν σε θέση να επιτύχουν τον καθαρισμό και την απομόνωση των «αντισωμάτων», ήθελα να δω καθαρές εικόνες από ηλεκτρονικό μικροσκόπιο αυτών των σωματιδίων σχήματος Υ που φαίνονται ακριβώς όπως απεικονίζονται μέσω των καλλιτεχνικών απεικονίσεων που δημιουργούνται μέσω υπολογιστή στα εγχειρίδια, τα κυρίαρχα μέσα ενημέρωσης και την επιστημονική βιβλιογραφία. Αναζητούσα άμεσες σαφείς οπτικές αποδείξεις ότι αυτές οι μοναδικού σχήματος ουσίες υπήρχαν μέσα στα υγρά όπως περιγράφονται, και όχι μόνο ως καρτούν και μοντέλα.
Όπως σημειώνεται στην εργασία του 1993 Ehrlich's «Beautiful Pictures» and the Controversial Beginnings of Immunological Imagery, είναι πεποίθηση ότι τα «αντισώματα» είναι βιοχημικές οντότητες στο αίμα, και η ιδέα αυτών των οντοτήτων ως μορίων σχήματος Υ οφείλεται στη διάδοση των εικόνων που συναντώνται σε σχολικά βιβλία, επιστημονικά άρθρα, διαφημίσεις, ακόμη και ως λογότυπα σε εταιρείες βιοτεχνολογίας.
«Ο όρος αντίσωμα σήμερα αναφέρεται σε διακριτές βιοχημικές οντότητες που υπάρχουν στο αίμα. Η πεποίθηση ότι τα αντισώματα είναι τέτοιες οντότητες δεν υποστηρίζεται μόνο από επιστήμονες και γιατρούς, αλλά και από το ευρύ κοινό, το οποίο μαθαίνει για τα «αντισώματα», αν όχι στο σχολείο, τουλάχιστον κατά τη διάρκεια των συνήθων ιατρικών πρακτικών όπως ο εμβολιασμός και, όλο και περισσότερο, μέσω της λεγόμενης εκλαΐκευσης της επιστήμης. Επιπλέον, μερικοί άνθρωποι θα συνδέσουν εύκολα τον όρο αντίσωμα με τη χαρακτηριστική δομή σχήματος Υ που βρίσκεται όχι μόνο σε εγχειρίδια και εξειδικευμένα επιστημονικά άρθρα, αλλά επίσης, πιο πρόσφατα, σε διαφημίσεις και ακόμη και ως λογότυπα φαρμακευτικών και βιοτεχνολογικών εταιρειών.
Οι συντάκτες της εργασίας κατέληξαν τελικά στο συμπέρασμα ότι, από την εποχή του Paul Ehrlich και των αρχικών σχεδίων του για την αόρατη οντότητα «αντισωμάτων», υπήρξε μια εννοιολογική απομάκρυνση από άμεσα παρατηρήσιμα φαινόμενα στην εξαγωγή συμπερασμάτων αόρατων οντοτήτων ή διαδικασιών (όπως οι «ανοσοποιητικές» αποκρίσεις), με βάση μακροσκοπικές πειραματικές αντιδράσεις που δημιουργήθηκαν στο εργαστήριο.
«Πέρα από αυτό το σημείο, αυτό που μας φαίνεται να είναι το κεντρικό ζήτημα στην προσπάθεια του Ehrlich είναι η καθιέρωση ενός πεδίου αόρατης συμπεριφοράς δειγμάτων και η συσχετισμένη ταύτιση παρατηρήσιμων μακροσκοπικών πειραματικών αντιδράσεων (συγκολλήσεις, κατακρημνίσεις κ.ο.κ.) με αόρατους συνδυασμούς νεοσυσταθεισών οντοτήτων. Ως αποτέλεσμα αυτού του συγκερασμού, η εκτέλεση ανοσολογικών πειραμάτων και η συγκρότηση νέων ανοσολογικών οντοτήτων έγιναν οι δύο όψεις ενός ενιαίου αναπαραστατικού νομίσματος».
Με αυτόν τον τρόπο, δημιουργήθηκε μια αναπαραστατική συντόμευση όπου αυτές οι παρατηρήσιμες αντιδράσεις συγχέονταν με υποτιθέμενες, αλλά ακόμα εντελώς αόρατες, βιολογικές οντότητες και μηχανισμούς. Αυτές οι αφηρημένες οντότητες θεωρήθηκαν τότε τόσο «πραγματικές» όσο και τα παρατηρήσιμα αποτελέσματα, παρά την έλλειψη οποιασδήποτε άμεσης απόδειξης για την ύπαρξή τους. Αυτή η συγχώνευση συσκοτίζει τη διάκριση μεταξύ του άμεσα μετρήσιμου και αυτού που συνάγεται από τους ερευνητές, εγείροντας ερωτήματα σχετικά με την εγκυρότητα των συμπερασμάτων που εξάγονται από τέτοια πειράματα. Δημιούργησε την ευκαιρία για τους ερευνητές να ξεχάσουν το γεγονός ότι αυτά τα σχέδια είναι υποθετικές αναπαραστάσεις αόρατων οντοτήτων και διαδικασιών που δεν έχει αποδειχθεί ότι αποτελούν άμεση αντανάκλαση της πραγματικότητας.
Το «αντίσωμα» είναι ένα εννοιολογικό μοντέλο που προήλθε από τον Ehrlich και εξελίχθηκε με την πάροδο του χρόνου στις τρέχουσες εικόνες σχήματος Υ, προκειμένου να χρησιμοποιηθεί για να εξηγήσει ορισμένες χημικές αντιδράσεις που παρατηρήθηκαν σε ανοσολογικά πειράματα, όπως η συγκόλληση (συσσώρευση σωματιδίων μαζί) ή η καθίζηση/κατακρήμνιση (διαλυτά αντιδρώντα που ενώνονται για να κάνουν ένα αδιάλυτο προϊόν, το ίζημα). Ωστόσο, παρά τα όσα αναφέρει η επιστημονική βιβλιογραφία, τα μοντέλα ενδέχεται να μην αναπαριστούν με ακρίβεια αυτό που συμβαίνει στην πραγματικότητα, ιδίως όταν πρόκειται για αυτό που ονομάστηκε «τομέας της αόρατης συμπεριφοράς των δειγμάτων». Προβλήματα προκύπτουν όταν οι ερευνητές αντιμετωπίζουν αυτές τις αφηρημένες αναπαραστάσεις σαν να είναι άμεσες αντανακλάσεις της πραγματικότητας, ενώ στην πραγματικότητα είναι απλώς κατασκευασμένες εξηγήσεις χρησιμοποιώντας μοντέλα που βασίζονται σε παρατηρούμενες αντιδράσεις. Η σύγχυση αυτού που μπορεί να παρατηρηθεί εμπειρικά με αυτό που είναι εντελώς θεωρητικό οδηγεί τους ερευνητές να κάνουν υποθέσεις σχετικά με αόρατες διαδικασίες που δεν τεκμηριώνονται πλήρως από τα δεδομένα των πειραμάτων τους. Καταλήγουν να προσαρμόζουν τα πειραματικά τους αποτελέσματα στο μοντέλο, προκειμένου να κάνουν τα πράγματα να «λειτουργούν».
Απηχώντας την ιολογία, ήξερα ότι για το μεγαλύτερο μέρος του χρόνου οι ανοσολόγοι ισχυρίζονταν ότι εργάζονται με αυτές τις οντότητες, δεν υπήρχαν άμεσες οπτικές απεικονίσεις. Το «αντίσωμα», όπως και ο «ιός», ξεκίνησε απλώς ως μια εννοιολογική ιδέα για την εξήγηση των αποτελεσμάτων που δημιουργήθηκαν στο εργαστήριο. Ξεκινώντας με αυτή την κατανόηση, ήθελα να εντοπίσω ακριβώς πότε αυτές οι οντότητες ισχυρίστηκαν για πρώτη φορά ότι παρατηρήθηκαν στην πραγματικότητα. Μετά από αναζήτηση στις κύριες ερευνητικές εργασίες από το 1890 έως τη δεκαετία του 1970, δεν μπόρεσα να βρω καμία άμεση απόδειξη ότι τα «αντισώματα» ήταν οι πρωτεΐνες σχήματος Υ ως οι οποίες απεικονίζονταν όλα αυτά τα χρόνια. Ήθελα να μάθω αν υπήρχαν πραγματικές εικόνες αυτών των σωματιδίων και ποιες μέθοδοι χρησιμοποιήθηκαν για τη δημιουργία αυτών των απεικονίσεων. Ήταν οι εικόνες καθαρισμένων, απομονωμένων σωματιδίων που ελήφθησαν απευθείας από τον ορό; Ήταν ανόθευτες ή ήταν αναπαραστάσεις που δημιουργήθηκαν από υπολογιστή και προσαρμόστηκαν σε ένα πλαίσιο ή μοντέλο;» Παρουσιάζονται εδώ όσα μπόρεσα να αποκαλύψω εκείνη την εποχή, μαζί με πρόσθετα σχόλια και έρευνες που έγιναν πρόσφατα, εξετάζοντας την προέλευση των απεικονίσεων του «αντισώματος» σε σχήμα Υ.
Μετά την ανασκόπηση των σημαντικότερων στιγμών και εργασιών στην ιστορία της έρευνας των «αντισωμάτων», κατέστη προφανές ότι κανένα από τα επιτεύγματα που αναδείχθηκαν σε αυτά τα χρονοδιαγράμματα δεν ανέφερε εικόνες καθαρισμένων και απομονωμένων «αντισωμάτων» που απεικονίζονταν απευθείας από τον ορό. Αντιθέτως, οι ερευνητές βασίστηκαν σε έμμεσα αποτελέσματα από πειράματα χημείας, χρησιμοποιώντας αυτά τα ευρήματα για να κάνουν υποθέσεις σχετικά με τα πιθανά μόρια που υπήρχαν, την εμφάνισή τους και τις υποτιθέμενες λειτουργίες τους με βάση αυτά τα έμμεσα στοιχεία. Διαπίστωσα ότι ήταν αδύνατο να εντοπίσω την πρώτη εικόνα ενός καθαρισμένου και απομονωμένου «αντισώματος», γεγονός που με οδηγεί στο ερώτημα αν υπάρχει καν μια τέτοια εικόνα. Είναι μάλλον περίεργο ότι η άμεση απεικόνιση που θα αποκάλυπτε το σωματίδιο σε σχήμα Υ απουσιάζει επιδεικτικά από τα βασικά ορόσημα στην ιστορία των «αντισωμάτων».
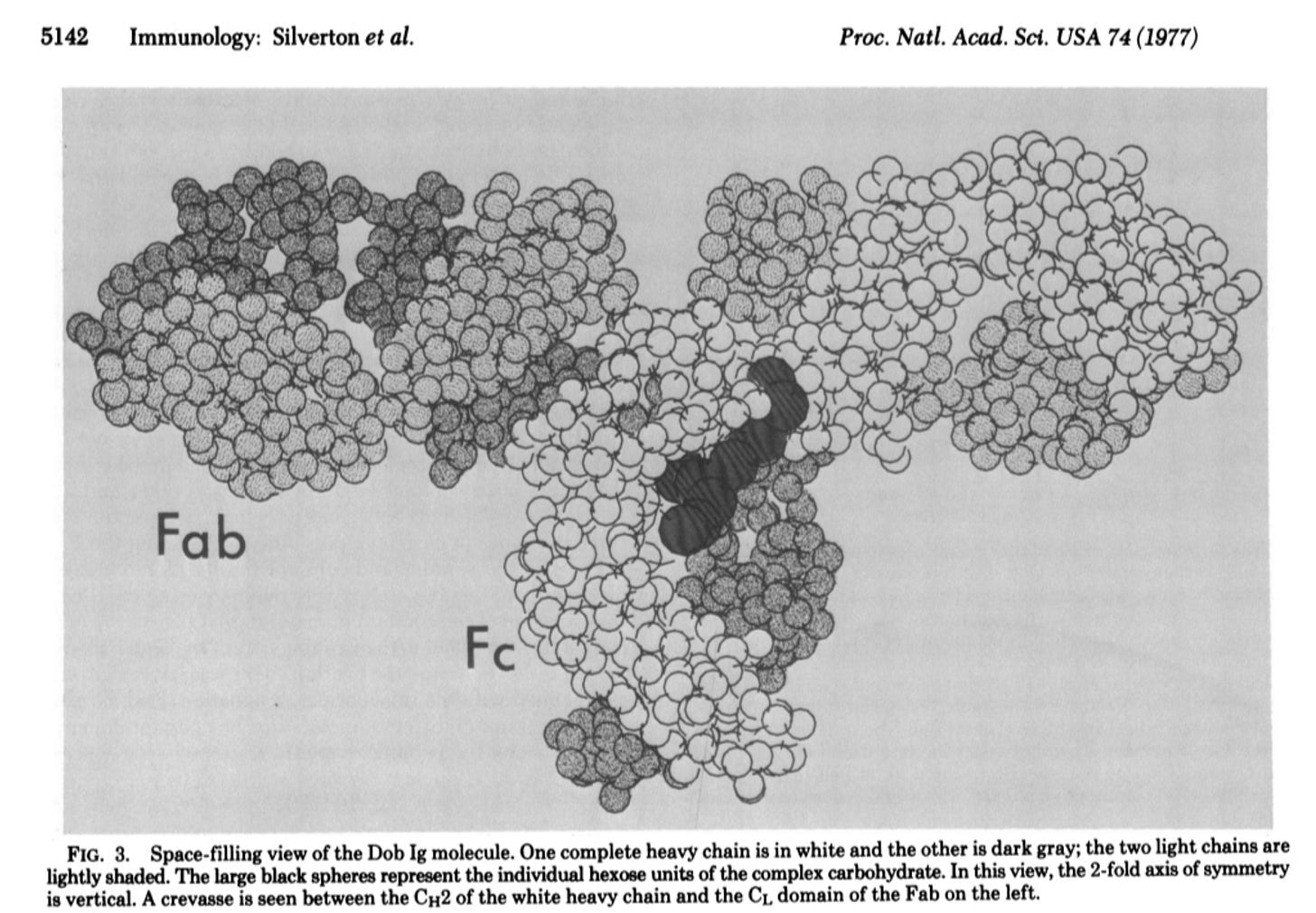
Η πλησιέστερη αναφορά σε οποιαδήποτε απεικόνιση που μπόρεσα να βρω ήταν από το χρονολόγιο του Nature "The History of Antibodies", όπου σημειώνεται ότι οι Enid W. Silverton, Manuel A. Navia και David R. Davies παρουσίασαν την πρώτη τρισδιάστατη δομή μιας ανοσοσφαιρίνης στην εργασία τους του 1977 Τρισδιάστατη δομή μιας άθικτης ανθρώπινης ανοσοσφαιρίνης. Προτού συζητήσουν τα ευρήματα αυτής της εργασίας, οι συγγραφείς ανέφεραν ότι προηγουμένως είχε προταθεί ένα αλλοστερικό μοντέλο ενός «αντισώματος» με βάση τα αποτελέσματα της περίθλασης ακτίνων Χ. Η περίθλαση ακτίνων Χ είναι μια τεχνική όπου υποστηρίζεται ότι οι ακτίνες Χ ανακλώνται από τα άτομα ενός κρυσταλλικού στερεού και αυτές οι διαθλώμενες ακτίνες-Χ δημιουργούν ένα μοτίβο που αποκαλύπτει τον δομικό προσανατολισμό κάθε ατόμου σε μια δεδομένη ένωση. Μια αναλογία του τρόπου λειτουργίας αυτής της διαδικασίας θα ήταν να ρίχνουμε ένα φως πάνω σε ένα αντικείμενο και να παρατηρούμε τη σκιά που ρίχνει. Ωστόσο, αντί να χρησιμοποιείται ορατό φως, χρησιμοποιούνται ακτίνες-Χ, και αντί για μια απλή σκιά, το μοτίβο που δημιουργείται θεωρείται πολύ πιο περίπλοκο. Όταν οι ακτίνες Χ πέφτουν σε μια κρυσταλλική πρωτεΐνη ή «αντίσωμα», διασκορπίζονται προς διάφορες κατευθύνσεις, δημιουργώντας ένα μοτίβο «σκιάς». Οι ερευνητές στη συνέχεια αναλύουν αυτό το μοτίβο και το χρησιμοποιούν για να ανακατασκευάσουν ένα 3D μοντέλο του αντικειμένου που προκάλεσε τη σκέδαση. Με αυτόν τον τρόπο, ακριβώς όπως θα μπορούσατε να συμπεράνετε το σχήμα ενός αντικειμένου από τη σκιά του, οι ερευνητές χρησιμοποιούν τις σκεδαζόμενες ακτίνες Χ για να συμπεράνουν τη δομή του μορίου. Ωστόσο, αντί να παρατηρούν άμεσα το ίδιο το αντικείμενο, βασίζονται σε αυτή τη «σκιά» (το μοτίβο περίθλασης) για να συνθέσουν την τρισδιάστατη -3D- δομή.
Υπάρχουν βάσιμες κριτικές και ανησυχίες σχετικά με αυτήν την τεχνική. Εάν πολλά αντικείμενα (ή τμήματα ενός μορίου) είναι στενά συνδεδεμένα μεταξύ τους ή επικαλύπτονται, η προκύπτουσα «σκιά» (μοτίβο περίθλασης) θα μπορούσε να είναι ένα μείγμα σημάτων από διάφορα διαφορετικά αντικείμενα. Αυτό σημαίνει ότι το τελικό μοντέλο, το οποίο ανακατασκευάζεται από αυτό το μοτίβο, μπορεί να μην αντιπροσωπεύει με ακρίβεια τα επιμέρους συστατικά ή την πραγματική τους διάταξη, ιδίως επειδή δεν υπάρχουν άμεσες εικόνες του «αντισώματος» για να επιβεβαιωθεί ότι το μοτίβο σκιάς αντιπροσωπεύει με ακρίβεια μια οντότητα που υπάρχει στη φύση. Με άλλα λόγια, το μοντέλο θα μπορούσε να είναι απλώς μια προσέγγιση ή μια ερμηνεία που δεν αποτυπώνει πλήρως την πολυπλοκότητα αυτού που πραγματικά δημιουργεί το μοτίβο περίθλασης. Η διαδικασία προϋποθέτει μια ορισμένη δομή κατά την προσαρμογή του μοντέλου, οπότε αν πολλαπλά αντικείμενα επηρεάζουν το μοτίβο, αυτό θα μπορούσε να οδηγήσει σε ένα μοντέλο που είναι παραπλανητικό. Αυτό που μοντελοποιείται μπορεί να μην αντικατοπτρίζει κάτι που συναντάται στη φύση και θα μπορούσε απλώς να είναι ένα δημιούργημα της ίδιας της διαδικασίας.
Οι συντάκτες της εργασίας του 1977 αναφέρθηκαν στο μοντέλο που δημιουργήθηκε από την ανάλυση μοτίβων περίθλασης φωτός από κρυσταλλωμένες πρωτεΐνες, ισχυριζόμενοι ότι συμπεραίνουν την τρισδιάστατη δομή των «αντισωμάτων» προκειμένου να το κατασκευάσουν. Αυτό το μοντέλο ήταν από την προηγούμενη έρευνά τους, μια εργασία του 1975 με τίτλο Δομές ανοσοσφαιρίνης σε υψηλή ανάλυση που τυπώθηκε από το βιβλίο Σύγχρονα θέματα μοριακής ανοσολογίας. Τόμος 4, που καλύπτει στις σελίδες 127-155. Στην εργασία αυτή, οι συγγραφείς σημείωναν ότι, πριν από την περίθλαση ακτίνων Χ υψηλής ανάλυσης, το έργο πολλών χημικών και φυσικοχημικών είχε παράσχει μόνο μια εικόνα «χαμηλής ανάλυσης» του «μορίου του αντισώματος». Έτσι, μέχρι αυτό το σημείο, η παρακάτω εικόνα, που παρουσιάζεται στο πλαίσιο της εργασίας, είναι αυτό που οι ερευνητές μπορούσαν να παρουσιάσουν ως «απόδειξη» του σωματιδίου «αντισώματος» σε σχήμα Υ.
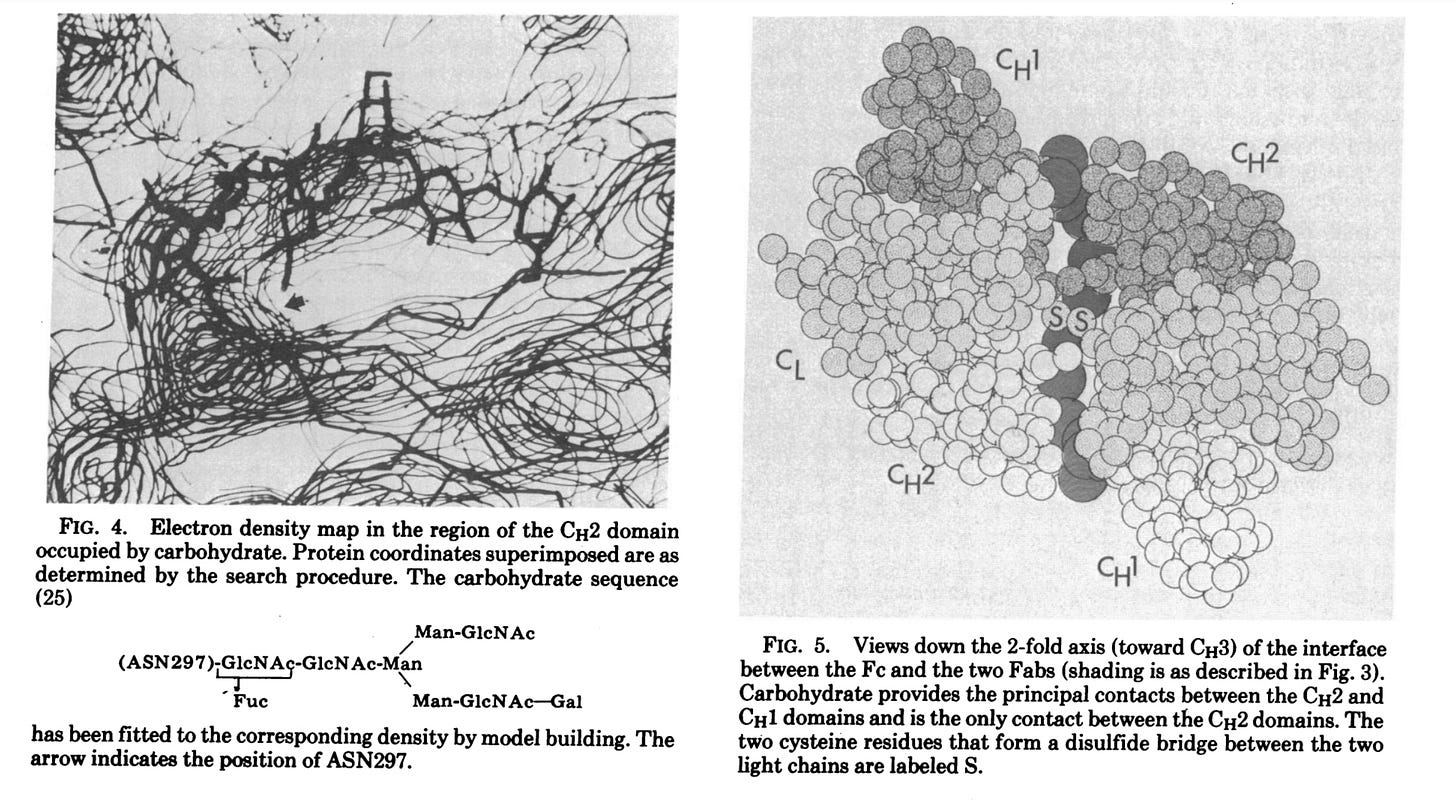
Σημείωσαν ότι, στην περίθλαση ακτίνων-Χ υψηλότερης ανάλυσης, ο κρυσταλλογράφος χρησιμοποιεί ουσιαστικά ένα μικροσκόπιο υψηλής ισχύος, όπου ο φακός αντικαθίσταται από τη σύνθεση των δεδομένων της περίθλασης ακτίνων-Χ από υπολογιστή. Για να επιτευχθεί αυτή η σύνθεση, είναι απαραίτητο να ληφθούν πληροφορίες σχετικά με τα πλάτη και τις φάσεις των μεγίστων της περίθλασης των ακτίνων Χ (ή των ανακλάσεων Bragg). Για πρωτεϊνικούς κρυστάλλους όπως τα «αντισώματα», οι φάσεις προσδιορίζονται έμμεσα με τη μέθοδο της πολλαπλής ισομορφικής αντικατάστασης. Οι συγγραφείς επεσήμαναν ότι «το όριο της ανάλυσης» αυτής της μεθόδου «διέπεται από την ποιότητα των κρυστάλλων, και για τις πρωτεΐνες αυτή είναι συνήθως σημαντικά φτωχότερη από ό,τι για τους κρυστάλλους μικρών μορίων». Οι κρυσταλλογράφοι πρωτεϊνών βασίζονται σε μια γνωστή αλληλουχία υπολειμμάτων αμινοξέων για να ερμηνεύσουν τους συχνά «μάλλον ασαφείς χάρτες» τους. Η ερμηνεία αυτή επιτυγχάνεται συνήθως με την κατασκευή ενός μοριακού μοντέλου που κλιμακώνεται στο χάρτη ηλεκτρονικής πυκνότητας και τοποθετείται απευθείας πάνω σε αυτόν (χρησιμοποιώντας τεχνικές όπως τα ημι-σχιστοειδή κάτοπτρα). Παραδέχθηκε ότι «η ακρίβεια του τελικού μοντέλου εξαρτάται σαφώς από την ποιότητα και την ανάλυση του χάρτη». Έτσι, μπορεί να συνοψιστεί ότι η περίθλαση ακτίνων Χ βασίζεται σημαντικά σε υποθέσεις σχετικά με την ποιότητα των κρυστάλλων και την ακρίβεια της ερμηνείας των δεδομένων για τη δημιουργία ενός μοντέλου που στοχεύει να αντικατοπτρίζει την πραγματικότητα. Είναι ενδιαφέρον ότι οι συγγραφείς σημείωσαν ότι η εικόνα των μελετών χαμηλής ανάλυσης IgG ευνοεί μια δομή σχήματος Τ και όχι τη δομή που συνήθως απεικονίζεται σε σχήμα Υ.
Στη δημοσίευσή τους του 1977, οι ερευνητές πραγματοποίησαν εκ νέου διερεύνηση του χάρτη ηλεκτρονικής πυκνότητας Dob 6-A χρησιμοποιώντας συστηματική αναζήτηση σε υπολογιστή για μεμονωμένες περιοχές. Ξεκίνησαν επιλέγοντας μια περιοχή του χάρτη ηλεκτρονιακής πυκνότητας Dob που πίστευαν ότι θα μπορούσε να αντιστοιχεί σε μια συγκεκριμένη περιοχή Ig, και οι συντεταγμένες της περιοχής στη συνέχεια περιστράφηκαν και μεταφράστηκαν συστηματικά μέχρι να δώσουν την καλύτερη προσαρμογή με αυτή την ηλεκτρονιακή πυκνότητα. Με απλά λόγια, επρόκειτο για μια εξ ολοκλήρου υπολογιστική διαδικασία που περιελάμβανε τη χρήση ενός υποτιθέμενου σχήματος ενός «αντισώματος» (ή ενός συγκεκριμένου τμήματός του) για να προσπαθήσουν να ταιριάξουν το σχήμα αυτό με τα δεδομένα που προέκυψαν από τον χάρτη ηλεκτρονικής πυκνότητας. Ουσιαστικά, οι ερευνητές ξεκίνησαν με μια υπόθεση σχετικά με το πώς μοιάζει το «αντίσωμα» και στη συνέχεια περιστρέψανε και μετατόπισαν αυτό το σχήμα με διάφορους τρόπους μέχρι να ταιριάζει καλύτερα με τα δεδομένα του χάρτη. Ο ίδιος ο χάρτης βασιζόταν στα προηγούμενα πειράματα, αλλά η διαδικασία προσαρμογής περιελάμβανε την εύρεση της καλύτερης αντιστοιχίας μεταξύ του υποτιθέμενου σχήματος και των δεδομένων. Με άλλα λόγια, δεν υπήρξε άμεση παρατήρηση του ίδιου του «αντισώματος» και αυτό που καταλήξαμε είναι οπτικές αναπαραστάσεις που βασίζονται σε υπολογιστικά μοντέλα που προσαρμόστηκαν στα δεδομένα προκειμένου να δημιουργηθούν όμορφες εικόνες CGI που απεικονίζουν αυτό που έχει μοντελοποιηθεί στο υποτιθέμενο «σχήμα Υ», το οποίο παραδόξως εμφανίζεται ως Τ, όπως σημειώνουν οι ερευνητές:
"Προς το παρόν, ωστόσο, δεν μπορούμε να αποκλείσουμε το ενδεχόμενο ότι η διαμόρφωση σχήματος Τ του Dob είναι απλώς το αποτέλεσμα της κρυσταλλικής συσκευασίας. Η πρωτεΐνη Kol, η οποία προφανώς έχει μια κανονική άρθρωση, έχει μια διαμόρφωση σχήματος Υ στον κρύσταλλο και έχει κατασκευαστεί ένα μοντέλο στο οποίο υπάρχει πολύ μικρή αλληλεπίδραση μεταξύ Fc και Fab.
Ακόμη και με αυτό το έργο που θεωρείται αρκετά σημαντικό για να τονιστεί από το Nature, δεν υπάρχει άμεση απεικόνιση ενός καθαρισμένου και απομονωμένου σωματιδίου «αντισώματος» σχήματος Υ που λαμβάνεται απευθείας από τον ορό. Ένας από τους σημαντικότερους περιορισμούς της περίθλασης ακτίνων Χ είναι ότι, όταν χρησιμοποιείται για την ταυτοποίηση μιας άγνωστης ουσίας, το δείγμα πρέπει να είναι μονοφασικό και ομοιογενές (δηλαδή, απολύτως το ίδιο). Δεδομένων των περιορισμών των σημερινών τεχνικών καθαρισμού, είναι αμφίβολο αν μόνο τα υποτιθέμενα μόρια «αντισωμάτων» θα είναι παρόντα στο δείγμα που χρησιμοποιείται για ανάλυση. Εάν το δείγμα περιέχει μείγμα διαφορετικών υλικών, η περίθλαση ακτίνων Χ ενδέχεται να μην ανιχνεύσει συστατικά που αποτελούν λιγότερο από το 2% του δείγματος λόγω των περιορισμών της στην ανίχνευση μικρών ή ιχνοστοιχείων, ιδίως σε μικτά δείγματα. Επομένως, η περίθλαση ακτίνων Χ δεν μπορεί να χρησιμοποιηθεί ως κύρια μέθοδος για τον προσδιορισμό της παρουσίας και της μορφής μιας άγνωστης ουσίας. Γνωρίζοντας αυτό, μου ήταν σαφές ότι θα έπρεπε να ψάξω έξω από τα χρονοδιαγράμματα των «αντισωμάτων» προκειμένου να βρω άμεσες εικόνες των ασύλληπτων σωματιδίων σχήματος Υ.
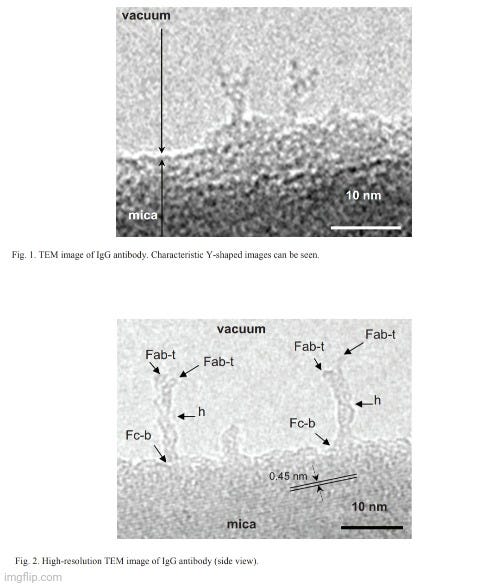
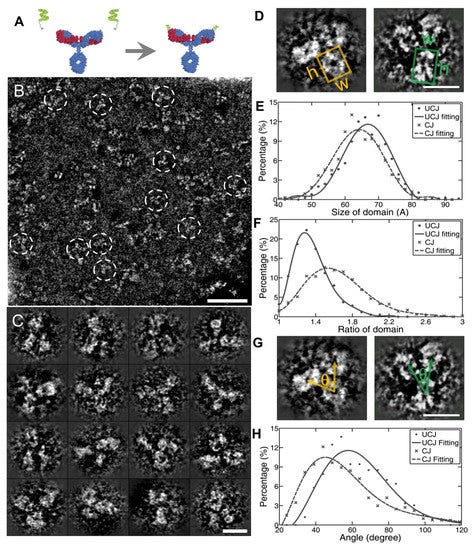
Στην αναζήτησή μου, τελικά βρήκα μια εργασία με τίτλο Transmission Electron Microscopy Observation of Antibody που δημοσιεύθηκε το 2012 στο περιοδικό Procedia Engineering. Στο έγγραφο, υποστηρίζεται ότι οι ερευνητές είχαν λάβει μια παρατήρηση ηλεκτρονικής μικροσκοπίας υψηλής ανάλυσης (TEM) ενός «αντισώματος». Οι συγγραφείς σημείωσαν ότι ήταν δύσκολο να παρατηρηθεί βιολογική ύλη όπως τα «αντισώματα» από το TEM λόγω της θεμελιωδώς ασθενούς αντίθεσης που πρέπει να αποφευχθεί μέσω της μεθόδου αρνητικής χρώσης. Ωστόσο, ακόμη και με αυτή τη μέθοδο, η ανάλυση των εικόνων TEM δεν ήταν αρκετή και η αρνητική χρώση μπορεί να κάνει πολύ ισχυρές εικόνες φόντου και συχνά προκαλεί μια αόριστα περιγεγραμμένη εικόνα του αντικειμένου. Έτσι, οι ερευνητές δήλωσαν ότι η παρατήρηση του βιολογικού αντικειμένου πρέπει να υποστηρίζεται στο κενό προκειμένου να ληφθούν εικόνες αυτών των ασύλληπτων σωματιδίων. Στη συνέχεια ισχυρίστηκαν ότι ήταν σε θέση να συλλάβουν εικόνες ενός «αντισώματος» που στέκεται στην άκρη του υποστρώματος μαρμαρυγίας στο κενό, οδηγώντας στην επιτυχία τους στη λήψη μιας εικόνας υψηλής ανάλυσης ενός μεμονωμένου «αντισώματος» χωρίς φόντο.
Το πρώτο πράγμα που πρέπει να σημειωθεί σχετικά με αυτή τη μελέτη είναι ότι οι εικόνες του "αντισώματος" δεν απεικονίζουν καθαρισμένες και απομονωμένες ουσίες που λαμβάνονται απευθείας από τον ορό ενός ξενιστή. Αντ 'αυτού, οι ερευνητές χρησιμοποίησαν ένα συνθετικό, εργαστηριακά δημιουργημένο μονοκλωνικό «αντίσωμα» (mAb) γνωστό ως αντι-Hen's Egg Lysozyme mAb (IgG1). Εξήγησαν ότι το «καθαρισμένο» mAb διαλυτοποιήθηκε έναντι φυσιολογικού ορού με ρυθμιστικό διάλυμα φωσφορικών αλάτων (PBS), με τα θραύσματα Fab και Fc του IgG1 mAb να παρασκευάζονται με πέψη με παπαΐνη και τα θραύσματα F(ab')₂ να παρασκευάζονται με πέψη με πεψίνη. Αυτή η διαδικασία θεωρητικά περιλαμβάνει τη διάσπαση του «αντισώματος» σε μικρότερα κομμάτια, πράγμα που σημαίνει ότι το τελικό προϊόν δεν θα είναι πλέον το άθικτο, πλήρους μεγέθους «αντίσωμα». Επιπλέον, η διαδικασία κατακερματισμού μπορεί να εισαγάγει άλλους παράγοντες που θα μπορούσαν να επηρεάσουν τη λειτουργικότητα ή την ερμηνεία πειραμάτων που περιλαμβάνουν αυτά τα θραύσματα. Αυτό ουσιαστικά ακυρώνει τον ισχυρισμό καθαρότητας, καθώς δεν υπάρχει καμία απόδειξη ότι στο δείγμα υπήρχαν μόνο σωματίδια «αντισώματος σε σχήμα Υ» πριν από τον κατακερματισμό. Επιπλέον, η ενζυμική πέψη θα μπορούσε να εισαγάγει άλλα μόρια ή υποπροϊόντα, ειδικά εάν η πέψη είναι ατελής ή εάν τα ένζυμα (παπαΐνη ή πεψίνη) δεν απομακρυνθούν πλήρως μετά. Με άλλα λόγια, το κατακερματισμένο μείγμα μπορεί να μην αντιπροσωπεύει πλέον ένα ενιαίο ομοιόμορφο προϊόν. Ανεξάρτητα από αυτό, αυτό δεν εμπόδισε τους ερευνητές να παρουσιάσουν τις δύο καλύτερες εικόνες TEM, για τις οποίες στη συνέχεια ισχυρίστηκαν ότι ήταν η πρώτη φορά που μια παρατήρηση TEM υψηλής ανάλυσης αποκάλυψε με επιτυχία το σχήμα και το αριθμητικό μέγεθος ενός μεμονωμένου μορίου «αντισώματος» στην κλίμακα νανομέτρων.
Το συμπέρασμα από την εργασία αυτή είναι ότι οι προηγούμενες εικόνες «αντισωμάτων» δεν ήταν σε θέση να αποτυπώσουν το σχήμα ή το μέγεθος μεμονωμένων μορίων «αντισωμάτων» σε τόσο ακριβή ανάλυση. Ωστόσο, λαμβάνοντας υπόψη τις διάφορες διαδικασίες που χρησιμοποιήθηκαν για τη λήψη και την ερμηνεία αυτών των εικόνων TEM, είναι αμφίβολο αν οι ερευνητές κατέγραψαν πραγματικά «αντισώματα». Αυτό φαίνεται να είναι ένα ακόμη σενάριο point-and-declare (“δείχνε-και-δήλωνε”), όπου τα απεικονιζόμενα σωματίδια μοιάζουν αόριστα με μια προκαθορισμένη ιδέα ή σχήμα που αποδίδεται σε μια υποθετική οντότητα, οδηγώντας σε έναν ισχυρισμό ότι μια τέτοια οντότητα υπάρχει. Είναι σημαντικό να θυμόμαστε ότι το γεγονός ότι οι ερευνητές πιστεύουν ότι απεικονίζουν ένα «αντίσωμα» δεν σημαίνει ότι είναι, στην πραγματικότητα, ένα «αντίσωμα». Όπως και με τους «ιούς», οι μέθοδοι που χρησιμοποιούνται για τον καθαρισμό, την απομόνωση και την προετοιμασία των δειγμάτων είναι είτε ανύπαρκτες, είτε ασαφείς, είτε ανεπιβεβαίωτες, είτε καταστροφικές για το ίδιο το δείγμα. Δεν έχω συναντήσει ακόμη άμεσες εικόνες που να ισχυρίζονται ότι δείχνουν καθαρισμένα και απομονωμένα «αντισώματα» απευθείας από τον ορό οποιουδήποτε ανθρώπου ή ζώου. Αυτό που συνήθως βρίσκουμε είναι ανακατασκευές και τρισδιάστατα μοντέλα που βασίζονται σε διάφορες μεθόδους, καθεμία από τις οποίες έχει τους δικούς της περιορισμούς, αφήνοντας τις εικόνες που προκύπτουν ανοιχτές σε αμφισβήτηση.
Για να καταδείξω περαιτέρω αυτό το τελευταίο σημείο, παρουσιάζω ολόκληρη την εργασία του 2018 που συνάντησα κατά την αναζήτησή μου και η οποία προσφέρει πολύτιμες πληροφορίες σχετικά με τις μεθόδους που χρησιμοποιούνται για τη λήψη των εικόνων προκειμένου να διατηρηθεί η ψευδαίσθηση του «αντισώματος». Το έγγραφο περιγράφει λεπτομερώς τις διάφορες τεχνικές απεικόνισης που χρησιμοποιούνται από τους ερευνητές, ενώ επισημαίνει επίσης τους περιορισμούς κάθε μεθόδου. Μετά την εξέταση αυτού του εγγράφου, θα πρέπει να γίνει σαφές γιατί αυτές οι εικόνες είναι αμφισβητήσιμες, ιδίως αν ληφθεί υπόψη ότι δεν γίνεται καμία αναφορά στο πώς ελήφθησαν τα δείγματα ή αν καθαρίστηκαν ποτέ πριν από την απεικόνιση. Είναι σημαντικό να θυμόμαστε κατά την ανάγνωση ότι, παρόλο που απεικονίζονται σωματίδια και υποστηρίζεται ότι είναι «αντισώματα», εξακολουθεί να λείπει η πειραματική εργασία που αποδεικνύει ότι αυτά τα σωματίδια είναι πράγματι τα υποτιθέμενα «αντισώματα» -και όχι τεχνουργήματα ή παραμορφώσεις- και ότι λειτουργούν όπως περιγράφεται. Οι ιστορίες σχετικά με τον τρόπο με τον οποίο σχηματίζονται και λειτουργούν αυτά τα σωματίδια βασίζονται σε μεγάλο βαθμό σε συμπεράσματα που προκύπτουν από δυνητικά ελαττωματικά δεδομένα και όχι σε άμεσες αποδείξεις. Αυτό υπογραμμίζει περαιτέρω την αμφισβητήσιμη φύση αυτών των εικόνων και των συμπερασμάτων που εξάγονται από αυτές.
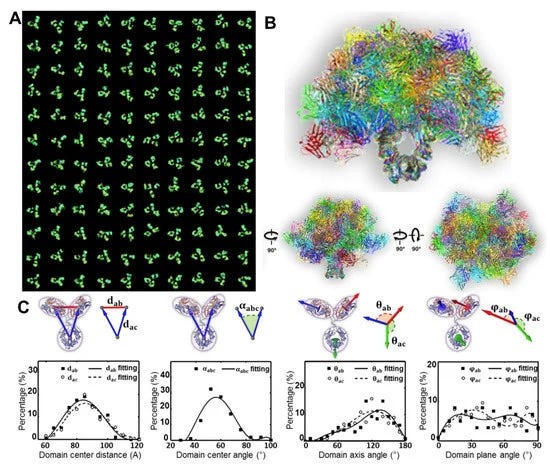
Ξεκινώντας με την εισαγωγή, οι συγγραφείς αναγνωρίζουν ότι η τρέχουσα τεχνολογία αγωνίζεται να εξακριβώσει τη δυναμική δομική συμπεριφορά των συμπλεγμάτων «αντισωμάτων» και των συμπλόκων «αντισωμάτων-αντιγόνου». Αυτή η παραδοχή είναι κρίσιμη, καθώς αποκαλύπτει ότι οι ερευνητές αντιμετωπίζουν προκλήσεις στην κατανόηση του τρόπου με τον οποίο αυτές οι δομές αλλάζουν, κινούνται ή αλληλεπιδρούν σε πραγματικό χρόνο. Οι πρωτεΐνες, συμπεριλαμβανομένων των «αντισωμάτων», λέγεται ότι παρουσιάζουν δομική μεταβλητότητα και ετερογένεια, που σημαίνει ότι είναι ευέλικτες και μπορούν να υπάρχουν σε πολλαπλές διαμορφώσεις. Οι πρωτεΐνες δεν είναι ομοιόμορφες, και στην περίπτωση των «αντισωμάτων», υποστηρίζεται ότι υπάρχουν πάνω από 10 δισεκατομμύρια τύποι. Αυτή η εγγενής μεταβλητότητα περιπλέκει τις προσπάθειες για τη σύλληψη μιας πλήρους και ακριβούς εικόνας αυτών των μορίων. Τέτοιοι περιορισμοί θα πρέπει να εγείρουν σοβαρά ερωτήματα σχετικά με την αξιοπιστία οποιωνδήποτε ισχυρισμών σχετικά με το ακριβές σχήμα ή τη λειτουργία αυτών των υποθετικών «αντισωμάτων».
Τρισδιάστατες δομές και δυναμική των αντισωμάτων IgG
Τα αντισώματα είναι ζωτικής σημασίας για την ανθρώπινη υγεία λόγω της ικανότητάς τους να λειτουργούν ως φάρμακα της φύσης προστατεύοντας το σώμα από λοιμώξεις. Τις τελευταίες δεκαετίες, τα αντισώματα έχουν χρησιμοποιηθεί ως φαρμακευτικά προϊόντα για στοχευμένη θεραπεία σε ασθενείς με καρκίνο, αυτοάνοσα νοσήματα και καρδιαγγειακά νοσήματα. Η καταγραφή της δυναμικής δομής των αντισωμάτων και ο χαρακτηρισμός της διακύμανσης των αντισωμάτων είναι ζωτικής σημασίας για τη βαθύτερη κατανόηση των δομικών χαρακτηριστικών τους και τη βελτίωση της ανάπτυξης φαρμάκων. Οι τρέχουσες τεχνικές για τη μελέτη της τρισδιάστατης (3D) δομικής ετερογένειας και μεταβλητότητας των πρωτεϊνών έχουν περιορισμούς στην εξακρίβωση της δυναμικής δομικής συμπεριφοράς των αντισωμάτων και των συμπλόκων αντισωμάτων-αντιγόνων. Εδώ, εξετάζουμε τις τρέχουσες τεχνικές που χρησιμοποιούνται για τη μελέτη των δομών αντισωμάτων με έμφαση στην πρόσφατα αναπτυγμένη τεχνική τομογραφίας ηλεκτρονίων ατομικών σωματιδίων (IPET). Το IPET, ως μεθοδολογία σωματιδίων προς σωματίδια για 3D δομικό χαρακτηρισμό, έχει επιδείξει πλεονεκτήματα στη μελέτη της δομικής ποικιλίας και των διαμορφωτικών αλλαγών των αντισωμάτων, παρέχοντας άμεσα δεδομένα απεικόνισης για βιομοριακή μηχανική για τη βελτίωση της ανάπτυξης και της κλινικής εφαρμογής συνθετικών αντισωμάτων.
1. Εισαγωγή
Τα αντισώματα, ή ανοσοσφαιρίνες (Ig), είναι γλυκοπρωτεΐνες που αποτελούν το χυμικό τμήμα του προσαρμοστικού ανοσοποιητικού συστήματος και καταπολεμούν παθογόνα όπως ιούς, βακτήρια, παράσιτα και νοσούντα κύτταρα [1]. Τα αντισώματα μοιράζονται περισσότερο από το 90% της ταυτότητάς τους στις πρωτογενείς αλληλουχίες τους. Μπορούν να χωριστούν σε πέντε μεγάλες κατηγορίες, συμπεριλαμβανομένων των IgA, IgD, IgE, IgG και IgM [2] με βάση τις βαριές αλυσίδες τους, οι οποίες διαφέρουν στις φυσικοχημικές και ορολογικές ιδιότητες καθώς και στη συμπεριφορά τους ως αντιγόνα [3,4]. Περίπου το 10-20% των πρωτεϊνών στο αίμα είναι πρωτεΐνες IgG. Λόγω της τεράστιας μεταβλητότητάς τους, τα αντισώματα πλάσματος έχουν περισσότερους από 10 δισεκατομμύρια τύπους, οι οποίοι μπορούν να ταξινομηθούν σε τέσσερις υποκατηγορίες: IgG1, IgG2, IgG3 και IgG4 [5], με τη σειρά φθίνουσας αφθονίας στον ορό [2]. Η IgG1, για παράδειγμα, ανταποκρίνεται κυρίως σε διαλυτά και μεμβρανικά πρωτεϊνικά αντιγόνα [6].
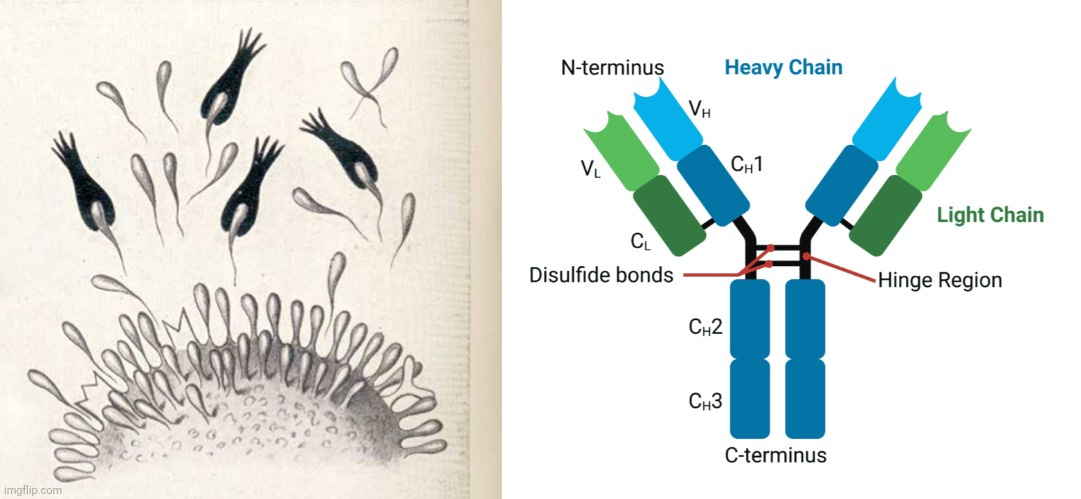
Τα αντισώματα περιέχουν δύο βραχίονες δέσμευσης αντιγόνου θραυσμάτων (Fab) που σχηματίζονται από ένα Ν-τερματικό μεταβλητό πεδίο βαριάς αλυσίδας (VH) και ένα μεταβλητό πεδίο ελαφριάς αλυσίδας (VL) (Σχήμα 1 Α). Τα VH και VL συνδέονται μεταξύ τους για να σχηματίσουν ένα μονομερές [H2L2 μέσω δεσμών δισουλφιδίου μεταξύ ή εντός αλυσίδας (S-S)] [7,8]. Κάθε βαριά αλυσίδα περιέχει ένα VH και τρεις έως τέσσερις σταθερές περιοχές (CH1, CH2 και CH3 ή Cγ1, Cγ2 και Cγ3). Αυτές οι μονάδες VH και VL βρίσκονται μαζί στη σχισμή δέσμευσης αντιγόνου και η περιοχή άρθρωσης μεταξύ CH1 και CH2 επιτρέπει στα αντισώματα (IgGs) να εμφανίζουν την ευελιξία τους κατά τη δέσμευση του αντιγόνου. Η κατώτερη περιοχή άρθρωσης μεταξύ CH2 και CH3 συνθέτει την κρυσταλλική περιοχή θραυσμάτων (Fc), η οποία είναι υπεύθυνη για τη δέσμευση IgG-Fc (FcγR, λειτουργία τελεστή), C1q (ενεργοποίηση συμπληρώματος) και τον νεογνικό υποδοχέα Fc (FcRn, ομοιόσταση και μεταφορά στον πλακούντα, εκτός από την IgG2) [9]. Η γλυκοζυλίωση της IgG1 συμβαίνει κυρίως στο Asn-297 των περιοχών CH2 [10].
Στην επόμενη ενότητα, οι συγγραφείς τόνισαν την ανάπτυξη της τεχνολογίας υβριδώματος από τους Georges Köhler και Cesar Milstein που χρησιμοποιήθηκε για τη δημιουργία των συνθετικών μονοκλωνικών «αντισωμάτων». Αυτό περιελάμβανε τη σύντηξη καρκινικών κυττάρων μυελώματος με κύτταρα σπλήνας από ποντίκι που είχε «ανοσοποιηθεί» με ερυθρά αιμοσφαίρια προβάτου. Οι θεραπείες που δημιουργούνται από αυτά τα τεχνητά παρασκευάσματα συνοδεύονται από σοβαρές παρενέργειες, όπως η ασθένεια του ορού - μια επικίνδυνη αντίδραση στο να δηλητηριαστεί κανείς από ξένες πρωτεΐνες στον αντιορό που προέρχεται από μη ανθρώπινη ζωική πηγή, με αποτέλεσμα εξάνθημα, πόνο στις αρθρώσεις, πυρετό και λεμφαδενοπάθεια. Οι συγγραφείς σημειώνουν ότι «ένας βασικός περιοριστικός παράγοντας στη βιοφαρμακευτική βιομηχανία είναι η αδυναμία των σημερινών μεθόδων να χαρακτηρίσουν πλήρως και αποτελεσματικά τη δομή των φαρμάκων που βασίζονται σε πρωτεΐνες με επαρκή ακρίβεια και ακρίβεια». Αυτό είναι ένα μάλλον ανησυχητικό κόκκινο πανί, καθώς ο ακριβής δομικός χαρακτηρισμός είναι απαραίτητος για τη διασφάλιση της αποτελεσματικότητας, της ασφάλειας και της συνέπειας των θεραπειών «με βάση τα αντισώματα». Αυτό θα πρέπει να εγείρει ανησυχίες σχετικά με την ακρίβεια των όποιων ισχυρισμών σχετικά με την ακριβή φύση και αποτελεσματικότητα αυτών των θεραπευτικών προϊόντων με βάση τις πρωτεΐνες. Εάν οι ερευνητές δεν είναι σε θέση να χαρακτηρίσουν σωστά τα «αντισώματα», θα είναι δύσκολο, αν όχι αδύνατο, να κατανοήσουν πλήρως τη δομή και τη συμπεριφορά των «αντισωμάτων», κάτι που είναι απαραίτητο για να διασφαλιστεί ότι λειτουργούν σωστά και με ασφάλεια σε θεραπευτικές εφαρμογές. Εάν τα «αντισώματα» ήταν πραγματικά καθαρισμένα και απομονωμένα, θα έπρεπε να είναι δυνατός ο πλήρης χαρακτηρισμός τους με τις υπάρχουσες τεχνικές. Παραδεχόμενοι τους περιορισμούς των υφιστάμενων μεθόδων, οι συγγραφείς αναγνωρίζουν σιωπηρά ότι οι διαδικασίες καθαρισμού και απομόνωσης είναι ανεπαρκείς, καθιστώντας έτσι αδύνατο τον πλήρη και ακριβή χαρακτηρισμό των σωματιδίων που ισχυρίζονται ότι είναι «αντισώματα».
Η παραγωγή μονοκλωνικών αντισωμάτων έχει μετατοπίσει τη βιολογική και φαρμακευτική έρευνα καθώς και την κλινική θεραπευτική [11]. Το 1975, οι Köhler και Milstein χρησιμοποίησαν για πρώτη φορά την τεχνολογία υβριδώματος για να αναπτύξουν ένα μονοκλωνικό αντίσωμα ποντικού για την καταπολέμηση της απόρριψης μοσχεύματος νεφρού [12]. Μέχρι στιγμής, περισσότερα από 60 θεραπευτικά προϊόντα μονοκλωνικών αντισωμάτων έχουν εγκριθεί στις ΗΠΑ ή την Ευρώπη, ενώ σχεδόν 100 αντισώματα δοκιμάζονται επί του παρόντος σε κλινικές δοκιμές [13,14]. Παρατηρήθηκε για πρώτη φορά με την ανάπτυξη του Humira (adalimumab) για τη θεραπεία της ρευματοειδούς αρθρίτιδας, πλήρως εξανθρωπισμένα αντισώματα έχουν δημιουργηθεί από τη συναρμολόγηση γονιδίων της περιοχής V των λεμφοκυττάρων που κλωνοποιήθηκαν για να εμφανίσουν θραύσματα Fab σε επιφάνειες βακτηριοφάγων [15]. Σήμερα, τα πλήρως εξανθρωπισμένα αντισώματα βελτιώνουν σημαντικά την ασφάλεια και την αποτελεσματικότητα των θεραπειών και διαγνωστικών που βασίζονται σε φάρμακα μονοκλωνικών αντισωμάτων, συμπεριλαμβανομένων των συστημάτων χορήγησης φαρμάκων συζευγμένων με αντισώματα, των θεραπειών καρκίνου που στοχεύουν σε ογκοπρωτεΐνες και των ανοσοθεραπειών για καρδιαγγειακές, νευροεκφυλιστικές και άλλες ασθένειες [16]. Στη βιοφαρμακευτική βιομηχανία, δέκα από τα δεκαπέντε φάρμακα με τις μεγαλύτερες πωλήσεις είναι πρωτεϊνικά βιολογικά και από αυτά, πέντε είναι μονοκλωνικά αντισώματα - η μεγαλύτερη κατηγορία βιοθεραπευτικών - τα οποία αντιπροσωπεύουν τουλάχιστον το 40% των φαρμάκων που αναπτύσσονται σήμερα. Ένας βασικός περιοριστικός παράγοντας στη βιοφαρμακευτική βιομηχανία είναι η αδυναμία των σημερινών μεθόδων να χαρακτηρίσουν τη δομή των πρωτεϊνικών φαρμάκων πλήρως και αποτελεσματικά με επαρκή ακρίβεια και ακρίβεια. Έτσι, εξετάζουμε αρκετές σημαντικές τεχνικές απεικόνισης για τον χαρακτηρισμό της δομής και της δυναμικής των αντισωμάτων».
Στο μέρος 2, οι συγγραφείς συζητούν διάφορες μεθόδους που χρησιμοποιούνται για την προσπάθεια χαρακτηρισμού του «αντισώματος». Ας εξετάσουμε κάθε μέθοδο για να δούμε αν κάποια από αυτές παρέχει άμεσες εικόνες καθαρισμένων και απομονωμένων σωματιδίων σχήματος Υ. Η πρώτη μέθοδος που συζητείται είναι η κρυσταλλογραφία ακτίνων Χ, η οποία σχετίζεται στενά με την περίθλαση ακτίνων Χ. Αυτή η τεχνική περιλαμβάνει την κρυστάλλωση πρωτεϊνών και την κατεύθυνση ακτίνων Χ στον κρύσταλλο για την παραγωγή ενός μοτίβου περίθλασης, το οποίο στη συνέχεια χρησιμοποιείται για τη δημιουργία ενός χάρτη ηλεκτρονικής πυκνότητας. Από αυτόν, ανακατασκευάζεται μια τρισδιάστατη δομή. Σύμφωνα με το έγγραφο, οι εικόνες που παράγονται με αυτή τη μέθοδο είναι από θραύσματα που υποστηρίζεται ότι αποτελούν μέρος των «αντισωμάτων» και όχι ολόκληρο το «αντίσωμα» σε σχήμα Υ στην ασύλληπτη μορφή του. Οι συγγραφείς παραδέχονται μάλιστα ότι η ερμηνεία της δομής πλήρους μήκους ενός «αντισώματος» αποτελεί πρόκληση με τη χρήση αυτής της τεχνικής.
Υπάρχουν αρκετά μειονεκτήματα που σχετίζονται με αυτή τη μέθοδο, συμπεριλαμβανομένης της απαίτησης για κρυσταλλικό δείγμα (οι πρωτεΐνες δεν είναι φυσικά κρυσταλλικές), ασάφειες στο μοντέλο λόγω των προκλήσεων στην απεικόνιση ολόκληρου του μορίου μέσα στον κρύσταλλο και της περιορισμένης ανάλυσης των δεδομένων περίθλασης, η οποία μπορεί να οδηγήσει σε ανεπίλυτες περιοχές ή τεχνουργήματα. Επιπλέον, ο θόρυβος του περιβάλλοντος μπορεί να εισαγάγει ανακρίβειες, περιπλέκοντας την ανάλυση δεδομένων.
Πέρα από αυτά τα ζητήματα, τα αποτελέσματα δεν είναι άμεσες εικόνες αλλά CGI ανακατασκευές, οι οποίες οι συγγραφείς αναγνωρίζουν ότι διαφέρουν μεταξύ τους. Αυτές οι ανακατασκευές, επομένως, δεν αντιπροσωπεύουν καθαρισμένα και απομονωμένα «αντισώματα», αλλά αντίθετα είναι ερμηνείες που αντλούνται από κατακερματισμένα δεδομένα.
2. Μέθοδοι χαρακτηρισμού της βασικής δομής αντισωμάτων
2.1. Κρυσταλλογραφία ακτίνων Χ
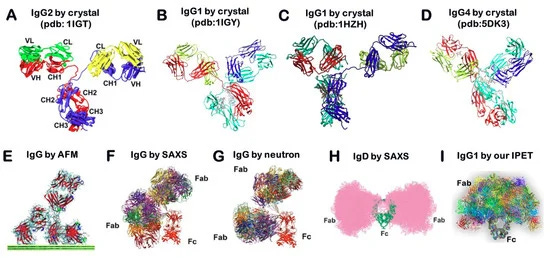
Η κρυσταλλογραφία ακτίνων Χ είναι μια δημοφιλής μέθοδος για τον προσδιορισμό της δομής των πρωτεϊνών. Σε αυτή την προσέγγιση, οι πρωτεΐνες απομονώνονται, συμπυκνώνονται και στερεοποιούνται σε κρυσταλλική μορφή. Στη συνέχεια εκτίθενται σε μια δέσμη ακτίνων Χ από την οποία τα σημεία περίθλασης επεξεργάζονται ως χάρτης πυκνότητας ηλεκτρονίων για την παραγωγή μιας τρισδιάστατης (3D) δομής [18]. Αν και εκατοντάδες δομές αντισωμάτων είναι διαθέσιμες μέσω της Τράπεζας Δεδομένων Πρωτεϊνών (PDB), οι περισσότερες από αυτές είναι θραύσματα αντισωμάτων, συνήθως ο βραχίονας Fab με έναν θύλακα σύνδεσης. Λόγω της φυσικής ευελιξίας των αντισωμάτων, η δομή πλήρους μήκους ενός αντισώματος είναι δύσκολο να προσδιοριστεί χρησιμοποιώντας κρυσταλλογραφία ακτίνων Χ. Εξ όσων γνωρίζουμε, έχουν προσδιοριστεί μόνο τέσσερις δομές αντισωμάτων IgG (καταχωρήσεις PDB: 1IGT [19], 1IGY [20] και IHZH [21]). Το 1IGT είναι ένα IGG2 ποντικού με 3 δεσμούς δισουλφιδίου (SS) άρθρωσης, ενώ το ανθρώπινο IGG2 έχει 4 δεσμούς SS. Το 1HZH είναι ανθρώπινη IgG1 με 2 δεσμούς SS, όπως και το 1IGY, μια IgG1 ποντικού. Αν και το αντίσωμα IgG4 πλήρους μήκους προσδιορίστηκε επίσης από την κρυσταλλική δομή, ο SS της άρθρωσης ήταν πιο σταθεροποιημένος λόγω της αλλαγής διαμόρφωσης της μετάλλαξης S228P (PDB entry 5DK3) [14]. Τέσσερις διαφορετικές διαμορφώσεις δείχνουν μια δομή σχήματος "Υ", ωστόσο, ο προσανατολισμός θέσης και η κατανομή των Fab περιοχών τους ήταν διαφορετικές (Σχήμα 1 A-D). Λαμβάνοντας υπόψη ότι όλες οι δομές προσδιορίστηκαν από τη στερεά κατάσταση της πρωτεΐνης, η μοναδική άκαμπτη διαμόρφωσή τους μπορεί να είναι ανεπαρκής για να δείξει κρίσιμα, δυναμικά δομικά χαρακτηριστικά στην κατάσταση διαλύματος, όπως διακυμάνσεις και στρέψεις.
Εικόνα 1. Δομή και δυναμική των αντισωμάτων. (A) Η κρυσταλλική δομή του ποντικού IgG2a (καταχώριση PDB: 1IGT) δείχνει ότι ένα αντίσωμα αποτελείται από δύο πανομοιότυπες βαριές πρωτεϊνικές αλυσίδες (μπλε και κόκκινο) σε συνδυασμό με δύο πανομοιότυπες ελαφριές αλυσίδες (πράσινο και κίτρινο), οι οποίες αποτελούνται από 7 (για σταθερές περιοχές) έως 9 (για μεταβλητές περιοχές) β-κλώνους (Copyright© Wikipedia). (B,C) Ωστόσο, οι κρυσταλλικές δομές του ποντικιού IgG1 και του ανθρώπινου IgG1 (καταχωρήσεις PDB: 1IGY και 1HZH) είναι διαφορετικές, ειδικά για τη θέση και τον προσανατολισμό των περιοχών Fab. (D) Η κρυσταλλική δομή ολόκληρου του μήκους του αντισώματος IgG4 προσδιορίστηκε επίσης από την κρυσταλλική δομή και ο μεντεσές SS απαλείφθηκε (καταχώριση PDB 5DK3). (E) Αυτές οι δομές είναι επίσης διαφορετικές από την IgG που αποκαλύφθηκε από τη μικροσκοπία ατομικής δύναμης (AFM) (Copyright© 2016 The Royal Society of Chemistry) [17], (F) σκέδαση ακτίνων Χ μικρής γωνίας (SAXS) και (G) σκέδαση νετρονίων (Copyright© 2012 Elsevier Ltd.). Αυτή η παραλλαγή είναι επίσης διαφορετική από εκείνη της (H) IgD σε διάλυμα που αποκαλύφθηκε από την SAXS (Copyright© 2005 Elsevier Ltd.) ή (I) της δομής και της διακύμανσης της IgG1 που λαμβάνεται με ηλεκτρονική τομογραφία αρνητικής χρώσης (NS-ET) και 3D ανακατασκευές τομογραφίας ηλεκτρονίων ατομικών σωματιδίων (IPET) [16]. Copyright© 2015 the Authors, υπό τη διαχείριση του Nature Publishing Group.
Η δεύτερη μέθοδος είναι γνωστή ως Μικροσκοπία Ατομικής Δύναμης (AFM) και δεν βασίζεται στο φως όπως τα κανονικά μικροσκόπια. Αντίθετα, αυτή η μέθοδος χρησιμοποιεί μια μικροσκοπική, αιχμηρή βελόνα που κινείται στην επιφάνεια ενός αντικειμένου που μελετάται. Καθώς η βελόνα κινείται πάνω από το αντικείμενο, υποστηρίζεται ότι οι αισθητήρες είναι σε θέση να ανιχνεύσουν το σχήμα και την υφή της επιφάνειας αισθανόμενοι τις δυνάμεις μεταξύ της βελόνας και του αντικειμένου. Αυτές οι δυνάμεις λέγεται ότι προκαλούν την κίνηση της βελόνας πάνω και κάτω, δημιουργώντας μια τρισδιάστατη -3D εικόνα της επιφάνειας του αντικειμένου. Είναι σημαντικό να σημειωθεί ότι αυτές οι εικόνες είναι ανακατασκευές που βασίζονται στις κινήσεις της βελόνας καθώς «αισθάνεται» την επιφάνεια του δείγματος και δημιουργεί έναν 3D χάρτη. Αυτές οι εικόνες είναι ουσιαστικά αναπαραστάσεις που δημιουργούνται από έμμεσες μετρήσεις και, όπως συμβαίνει με κάθε τεχνική απεικόνισης, υπάρχει κίνδυνος τεχνουργημάτων που μπορεί να προκύψουν από ακατάλληλο άκρο, μη βέλτιστες συνθήκες λειτουργίας ή ακόμα και από το ίδιο το δείγμα. Οι ίδιοι οι συγγραφείς σημειώνουν ότι αυτές οι εικόνες χαρακτηρίζουν ανεπαρκώς τη δομή 3D, καθώς μπορούν να περιέχουν αντικείμενα.
2.2. Μικροσκοπία ατομικής δύναμης (AFM)
Το AFM είναι ένα εργαλείο για την απεικόνιση της επιφανειακής τοπογραφίας μακρομορίων μέσω της μετακίνησης ενός αιχμηρού άκρου προσαρτημένου σε ένα μαλακό πρόβολο [22]. Αν και το AFM επιτρέπει την απεικόνιση αντισωμάτων και άλλων βιομορίων στο εγγενές τους περιβάλλον, οι εικόνες επιφανειακής τοπογραφίας χαρακτηρίζουν ανεπαρκώς την 3D δομή με εικόνες που ενδεχομένως περιέχουν τεχνουργήματα από την αλληλεπίδραση των μορίων με το υπόστρωμα στήριξης. Χρησιμοποιώντας AFM υψηλής ταχύτητας, μπορεί να παρατηρηθεί άμεσα η εγγενής διακύμανση και η δυναμική φύση των αντισωμάτων (Σχήμα 1 E) [17,23]. Το κύριο πλεονέκτημα αυτής της τεχνολογίας περιλαμβάνει το γεγονός ότι παρέχει ένα εργαλείο για τον ποσοτικό προσδιορισμό της πρωτεΐνης σε ανάλυση νανομέτρων και την εφαρμογή δυνάμεων στο καθεστώς pico-Newton, το οποίο επιτρέπει τη σύγκριση της ευελιξίας μεταξύ πρωτεϊνών για τη μηχανική μέτρηση μεμονωμένων πρωτεϊνών. Επιπλέον, οι βελτιώσεις στη μεθοδολογία επέτρεψαν την βιντεοσκόπηση της δυναμικής της πρωτεΐνης σε πραγματικό χρόνο, όπως τα αντισώματα που «περπατούν» στο υπόστρωμα [23]. Οι εικόνες AFM υψηλής ανάλυσης βιομορίων και συγκροτημάτων μπορούν να αποκαλύψουν υπομοριακές λεπτομέρειες με τη δυνατότητα άμεσης παρατήρησης αλλαγών διαμόρφωσης, όπως η σύνδεση μονοκλωνικών αντισωμάτων με διάφορους εταίρους [23].
Η σκέδαση μικρής γωνίας (SAS) είναι μια ακόμη έμμεση μέθοδος που βασίζεται στο μοτίβο σκέδασης των ακτίνων Χ. Αυτή η μέθοδος χρησιμοποιεί μια δέσμη ακτίνων Χ (ή νετρονίων) που κατευθύνεται σε ένα δείγμα. Καθώς η δέσμη χτυπά το δείγμα, τα σωματίδια στο εσωτερικό διασκορπίζουν το φως σε πολύ μικρές γωνίες. Το μοτίβο αυτού του σκεδασμένου φωτός μετράται και οι ερευνητές το χρησιμοποιούν προκειμένου να λάβουν πληροφορίες σχετικά με το συνολικό σχήμα και το μέγεθος των σωματιδίων στο εσωτερικό του δείγματος.
Το κύριο μειονέκτημα αυτής της τεχνικής είναι ότι η ερμηνεία της εξαρτάται από το μοντέλο, πράγμα που σημαίνει ότι οι ερευνητές πρέπει να προτείνουν μια θεωρητική δομή και να συγκρίνουν την αναμενόμενη σκέδαση από αυτή τη δομή με τα πειραματικά δεδομένα. Ως αποτέλεσμα, οι εικόνες που παράγονται είναι ανακατασκευασμένα μοντέλα με βάση το μοτίβο σκέδασης και τις υποθέσεις σχετικά με τη δομή του δείγματος, παρά άμεσες εικόνες. Αυτές οι ανακατασκευές επηρεάζονται από προκατασκευασμένες αντιλήψεις της δομής, οι οποίες επηρεάζουν την ερμηνεία του τρόπου σκέδασης του φωτός από τα σωματίδια. Εν ολίγοις, δεν πρόκειται για άμεσες εικόνες των ασύλληπτων «αντισωμάτων». Οι συγγραφείς σημειώνουν επίσης ότι οι ανακατασκευασμένες εικόνες διέφεραν ανάλογα με τη συγκεκριμένη τεχνική που χρησιμοποιήθηκε, υπογραμμίζοντας περαιτέρω τους περιορισμούς αυτής της προσέγγισης.
2.3. Μέθοδος σκέδασης μικρής γωνίας (SAS)
Η SAS, η οποία περιλαμβάνει σκέδαση ακτίνων Χ μικρής γωνίας (SAXS) και σκέδαση νετρονίων μικρής γωνίας (SANS), είναι μια γρήγορη αναλογική μέθοδος που χρησιμοποιείται για τη μελέτη της δομικής ποικιλίας αντικειμένων σε διαλύματα σε αναλύσεις μεταξύ 1 και 25 nm. Μέσω των καμπυλών σκέδασης του βιολογικού δείγματος που εκτίθεται κάτω από δέσμες ακτίνων Χ ή νετρονίων, οι πειραματικές καμπύλες μπορούν να μοντελοποιηθούν για την αποκάλυψη του μέσου μεγέθους σωματιδίων, του σχήματος και της αναλογίας επιφάνειας προς όγκο. Ωστόσο, η διακύμανση των IgG που αποκαλύφθηκε από τη σκέδαση ακτίνων Χ (Σχήμα 1F) [24] και τη σκέδαση νετρονίων (Σχήμα 1G) [24] παρουσίασε διαφορετικό πρότυπο κατανομής από αυτό των IgD που αποκαλύφθηκε από την τεχνική SAXS (Σχήμα 1H) [25] ή AFM (Σχήμα 1 E) [17]. Η μελέτη των αντισωμάτων στο διάλυμα έδειξε ότι οι βραχίονες των IgG είναι εξαιρετικά εύκαμπτοι και έχουν ένα ευρύ φάσμα γωνιών Fab-Fab και Fab-Fc και οι συλλογικές κινήσεις των βραχιόνων συχνά συμβάλλουν στην ικανότητα των IgG να δεσμεύουν τα αντιγόνα τους.
Για τη φασματοσκοπία πυρηνικού μαγνητικού συντονισμού (NMR), υποστηρίζεται ότι τοποθετώντας ένα δείγμα σε ένα ισχυρό μαγνητικό πεδίο και βομβαρδίζοντάς το με ραδιοκύματα, ορισμένοι ατομικοί πυρήνες μέσα στο δείγμα θα απορροφήσουν και στη συνέχεια θα επανεκπέμπουν αυτά τα κύματα. Με τη μέτρηση των εκπεμπόμενων σημάτων, οι επιστήμονες μπορούν να συμπεράνουν τη διάταξη των ατόμων μέσα στο μόριο και, από αυτά τα δεδομένα, να ανακατασκευάσουν ένα μοντέλο της υποτιθέμενης δομής του.
Ωστόσο, υπάρχουν σημαντικά μειονεκτήματα σε αυτή τη μέθοδο που θέτουν υπό αμφισβήτηση την ακρίβεια αυτών των μοντέλων. Ένας βασικός περιορισμός της φασματοσκοπίας NMR είναι η εγγενής αναισθησία της, που σημαίνει ότι απαιτούνται υψηλές συγκεντρώσεις ενός δείγματος για να παραχθούν αξιοποιήσιμα σήματα. Αυτό αποτελεί πρόκληση για την απεικόνιση πρωτεϊνών που ισχυρίζονται ότι είναι «αντισώματα», καθώς έχει αποδειχθεί δύσκολο, αν όχι αδύνατο, να καθαριστούν και να απομονωθούν αρκετά από αυτά τα σωματίδια από τον ορό, ώστε να παραχθεί μια σαφής και ακριβής εικόνα. Ως αποτέλεσμα, τα δεδομένα που λαμβάνονται είναι πιθανότατα ελλιπή ή ανακριβή, αναγκάζοντας τους ερευνητές να βασίζονται σε έμμεσα συμπεράσματα σχετικά με τη δομή αυτών των σωματιδίων αντί να παράγουν οριστικές εικόνες απομονωμένων «αντισωμάτων».
Επιπλέον, οι τεχνικές NMR είναι ιδιαίτερα ευαίσθητες στην κίνηση και αυτή η ευαισθησία μπορεί να οδηγήσει σε παραμορφώσεις του σήματος. Αυτές οι παραμορφώσεις συχνά εκδηλώνονται ως τεχνουργήματα στις εικόνες, καθιστώντας δύσκολη τη διάκριση των γνήσιων δομών «αντισωμάτων» από τις οπτικές παραμορφώσεις. Κατά συνέπεια, οι εικόνες που παράγονται μπορεί να μην αντιπροσωπεύουν με ακρίβεια τα σωματίδια που μελετώνται και, αντίθετα, να αντικατοπτρίζουν τεχνουργήματα, παραπλανώντας τους ερευνητές σχετικά με την πραγματική δομή και λειτουργία των απεικονιζόμενων σωματιδίων. Τελικά, όπως και με άλλες μεθόδους που συζητήθηκαν, το NMR δεν παρέχει άμεσες εικόνες των «αντισωμάτων» και συνήθως θεωρείται ως συμπληρωματικό εργαλείο και όχι ως οριστική μέθοδος για τον προσδιορισμό της δομής.
2.4. Φασματοσκοπία πυρηνικού μαγνητικού συντονισμού (NMR)
Το NMR είναι μια καθιερωμένη και δημοφιλής μέθοδος για τον προσδιορισμό δομικών χαρακτηριστικών για μικρά μόρια συνήθως μικρότερα από 40 kDa, [26] το οποίο είναι πολύ μικρότερο από το πλήρες μήκος ενός αντισώματος (συνήθως 160 kDa). Χρησιμοποιώντας την επισημασμένη πρωτεΐνη 15N-, 13C- και ενδεχομένως 2H για την ανάθεση συντονισμού, αυτή η τεχνική μπορεί να χρησιμοποιηθεί για τη μελέτη αντισωμάτων σε σύμπλοκα σε ασθενή και παροδική κατάσταση σε πολύ στενή κατάσταση. Τα σκευάσματα μονοκλωνικών αντισωμάτων σε γλουταμινικά διαλύματα που χαρακτηρίζονται από τους Kheddo et al. [27] διερεύνησαν την ικανότητα χαρακτηρισμού της μοριακής μεταφραστικής διάχυσης και συσσωμάτωσης για ιδανική σύνθεση [28]. Ωστόσο, τα τεχνικά εμπόδια, όπως η επίτευξη βέλτιστης συγκέντρωσης διαλύματος, η στενή παρακολούθηση της έκτασης της αυτοσυσχέτισης και το υψηλό επίπεδο εμπειρογνωμοσύνης που απαιτείται για τη διαδικασία, εξηγούν γιατί αυτή η μεθοδολογία, η οποία είναι ευαίσθητη σε παροδικές αλληλεπιδράσεις μεταξύ πρωτεϊνών, θεωρείται ως εργαλείο για την παροχή χρήσιμων συμπληρωματικών πληροφοριών για τη διαμόρφωση μονοκλωνικών αντισωμάτων και άλλων θεραπευτικών πρωτεϊνών [29, 30].
Η ηλεκτρονική μικροσκοπία μετάδοσης (TEM) είναι πραγματικά η μόνη μέθοδος που αναφέρεται στο άρθρο που θα μπορούσε θεωρητικά να παρέχει μια άμεση εικόνα των σωματιδίων που ισχυρίζονται ότι είναι «αντισώματα». Σε αυτή τη μέθοδο, μια δέσμη ηλεκτρονίων περνά μέσα από ένα λεπτό δείγμα που έχει προετοιμαστεί μέσω διαφορετικών διαδικασιών απεικόνισης. Καθώς λέγεται ότι τα ηλεκτρόνια έχουν πολύ μικρότερα μήκη κύματος από το φως, το TEM αποκαλύπτει λεπτομέρειες που είναι πολύ μικρότερες από αυτές που μπορούν να παρατηρηθούν με τα μικροσκόπια φωτός. Όταν χρησιμοποιείται για την απεικόνιση πρωτεϊνών, το δείγμα συχνά καταψύχεται προκειμένου να διατηρηθεί η φυσική του δομή. Υποστηρίζεται ότι τα ηλεκτρόνια αλληλεπιδρούν με τα άτομα στο δείγμα, το οποίο καταγράφεται προκειμένου να παραχθεί μια 2D εικόνα. Για να δημιουργηθεί μια 3D ανακατασκευή μιας πρωτεΐνης, πολλαπλές 2D εικόνες λαμβάνονται από διαφορετικές γωνίες και συνδυάζονται χρησιμοποιώντας αλγόριθμους υπολογιστών για να δημιουργήσουν ένα 3D μοντέλο της πρωτεΐνης. Ωστόσο, είναι σημαντικό να αναγνωρίσουμε ότι αυτά τα μοντέλα δεν είναι άμεσες εικόνες, αλλά μάλλον μια ανακατασκευή βασισμένη στο πώς οι πρωτεΐνες αλληλεπιδρούν με τα ηλεκτρόνια.
Επιπλέον, υπάρχουν αρκετά μειονεκτήματα στο TEM που θα πρέπει να αμφισβητήσουν την ακρίβεια των εικόνων που λαμβάνονται μέσω αυτής της μεθόδου, ειδικά όταν πρόκειται για νανοσωματίδια που δεν είναι παρατηρήσιμα με γυμνό μάτι. Η TEM δεν μπορεί να χρησιμοποιηθεί για τη μελέτη ζωντανών δειγμάτων λόγω της απαίτησης για κενό και δέσμη ηλεκτρονίων υψηλής ενέργειας, η οποία παράγει σημαντική θερμότητα. Η προετοιμασία του δείγματος συχνά περιλαμβάνει χημική σταθεροποίηση, αφυδάτωση με αλκοόλη, χρώση βαρέων μετάλλων, ενσωμάτωση σε ρητίνη και τεμαχισμό, γεγονός που εξασφαλίζει ότι τίποτα δεν παραμένει ζωντανό στο δείγμα. Ως αποτέλεσμα, οι βιολογικές αλληλεπιδράσεις δεν μπορούν να παρατηρηθούν με ακρίβεια και οι σκληρές διαδικασίες προετοιμασίας και απεικόνισης μπορεί να παραμορφώσουν το φυσικό σχήμα της πρωτεΐνης και να εισαγάγουν τεχνουργήματα απεικόνισης. Αυτό σημαίνει ότι τα σωματίδια που απεικονίζονται μπορεί να μην αντιπροσωπεύουν πραγματικά τις δομές που υπάρχουν στο αρχικό δείγμα.
2.5. Μέθοδος ηλεκτρονικής μικροσκοπίας μετάδοσης (TEM) για απεικόνιση και την τρισδιάστατη -3D- ανακατασκευή πρωτεϊνών
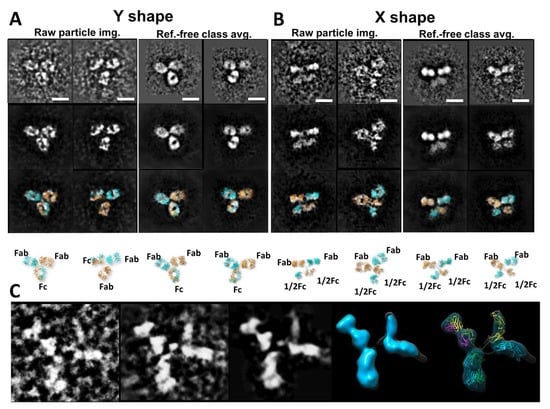
Η TEM μπορεί να προσδιορίσει τις δομές των μακρομορίων και τα σύμπλοκά τους μέσω δισδιάστατων προβολών αντικειμένων. Μπορούν να διακριθούν διάφοροι τύποι τεχνικών TEM. Με βάση την προετοιμασία του δείγματος, η τεχνική TEM μπορεί να ονομαστεί αρνητική χρώση (NS), θετική χρώση (PS), κρυο-ηλεκτρονική μικροσκοπία (cryo-EM), κρυο-αρνητική χρώση (cryo-NS) και κρυο-θετική χρώση (cryo-PS). Με βάση τις μεθόδους τρισδιάστατης ανακατασκευής, οι προσεγγίσεις TEM μπορούν να αναγνωριστούν ως κρυσταλλογραφία ηλεκτρονίων, 3D ανακατασκευή ενός σωματιδίου (μέθοδος ταξινόμησης και μέσου όρου) και ηλεκτρονική τομογραφία (ET). Πρόσφατα, μια μελέτη που χρησιμοποιεί την τεχνική NS και ET [31] έδειξε ότι η χωρική κατανομή των περιοχών Fab είναι πολύ ευρύτερη από προηγούμενες εκθέσεις (Σχήμα 1I). Στις επόμενες ενότητες, θα παρουσιάσουμε εν συντομία μερικές από αυτές τις μεθόδους.
Η αρνητική και η θετική χρώση είναι τεχνικές που χρησιμοποιούνται για τη βελτίωση των εικόνων TEM, αλλά δεν παρέχουν τέλειες ή εξαιρετικά λεπτομερείς εικόνες. Και οι δύο μέθοδοι μπορούν να επηρεάσουν τη φυσική μορφή της πρωτεΐνης κατά την προετοιμασία του δείγματος, εγείροντας ερωτήματα σχετικά με το αν τα σωματίδια που απεικονίζονται υπάρχουν πραγματικά στην ίδια μορφή στη φύση. Τα ίδια μειονεκτήματα που σημειώθηκαν για την TEM εξακολουθούν να ισχύουν και εδώ.
Στην αρνητική χρώση (NS) TEM, οι πρωτεΐνες ή τα μικρά σωματίδια περιβάλλονται από μια χρώση βαρέων μετάλλων, όπως το οξικό ουρανύλιο, το οποίο γεμίζει τους κενούς χώρους γύρω τους. Όταν τα ηλεκτρόνια περνούν μέσα από το δείγμα, η χρώση φαίνεται σκούρα ενώ οι πρωτεΐνες παραμένουν φωτεινές, δημιουργώντας μια εικόνα υψηλής αντίθεσης. Ωστόσο, δεδομένου ότι η χρώση περιβάλλει την πρωτεΐνη, οι λεπτότερες λεπτομέρειες μπορεί να μην είναι τόσο ακριβείς. Επίσης, οι συγγραφείς σημείωσαν ότι η NS παρέχει εικόνες σχετικά χαμηλής ανάλυσης όπου οι αλληλεπιδράσεις χρώσης-πρωτεϊνών μπορεί να προκαλέσουν τεχνουργήματα όπως συσσωμάτωση, επιπέδωση και στοίβαξη.
Στην ΤΕΜ με θετικό περιεχόμενο (PS), η χρώση δεσμεύεται απευθείας στην πρωτεΐνη, με αποτέλεσμα η πρωτεΐνη να εμφανίζεται πιο σκούρα στην εικόνα. Ενώ αυτή η τεχνική αναδεικνύει συγκεκριμένα μέρη της πρωτεΐνης, μπορεί επίσης να μεταβάλει τη δομή της πρωτεΐνης, οπότε το αποτέλεσμα της απεικόνισης μπορεί να μην αντικατοπτρίζει την πραγματική μορφή της πρωτεΐνης όπως υπάρχει στη φύση.
2.6. Ηλεκτρονική μικροσκοπία διέλευσης (TEM) αρνητικής περιεκτικότητας (NS) και θετικής περιεκτικότητας (PS) για την απεικόνιση πρωτεϊνών
Οι NS και PS είναι σχετικά παλαιότερες μέθοδοι που αναπτύχθηκαν για πρώτη φορά από τους Errera, Welch και Nuttal στη δεκαετία του 1890 για να ενισχύσουν ορισμένα επιφανειακά χαρακτηριστικά των μικροοργανισμών, που εξετάστηκαν με τη βοήθεια του μικροσκοπίου φωτός [32]. Στη δεκαετία του 1950, οι Farrant [33] και Hall [34] χρησιμοποίησαν για πρώτη φορά αυτή τη μέθοδο για να απεικονίσουν βιολογικά δείγματα με TEM. Με την επικάλυψη μορίων με φορτισμένα άλατα βαρέων μετάλλων, η NS απέκτησε απεικόνιση μορίων υψηλής αντίθεσης μέσω αυξημένης σκέδασης ηλεκτρονίων από τα ιόντα βαρέων μετάλλων γύρω από τα δείγματα [35] σε σχέση με τη σκέδαση ηλεκτρονίων από τα λιγότερο πυκνά άτομα των πρωτεϊνών [36,37,38,39]. Στο πρωτόκολλο PS, τα βαρέα μέταλλα δεσμεύονται σε επιλεκτικά συστατικά κυττάρων για να εμφανίσουν αυξημένη πυκνότητα της δέσμης ηλεκτρονίων στο δείγμα. Στο PS, τα δείγματα TEM πρέπει να πλυθούν σε απεσταγμένο νερό και να στεγνώσουν στον αέρα για να παρατηρηθεί η θετική πυκνότητα των πρωτεϊνών [40,41].
Στη βελτιστοποιημένη αρνητική χρώση (OpNS), όπως και στην κανονική αρνητική χρώση, οι πρωτεΐνες εξακολουθούν να περιβάλλονται από χρώση βαρέων μετάλλων. Η κύρια διαφορά είναι ότι η διαδικασία υποτίθεται ότι είναι προσεκτικά ρυθμισμένη ώστε να ελαχιστοποιούνται οι παραμορφώσεις του σχήματος της πρωτεΐνης καθώς και να βελτιώνεται η αντίθεση της εικόνας. Ο στόχος είναι να προσπαθήσουμε να μειώσουμε την ποσότητα της ζημιάς στην πρωτεΐνη και να πάρουμε πιο καθαρές εικόνες με πιο ορατές λεπτομέρειες. Ωστόσο, το OpNS εξακολουθεί να μην δίνει μια τέλεια αναπαράσταση της πρωτεΐνης όπως υπάρχει στη φύση για διάφορους λόγους. Πρώτον, η χρώση βαρέων μετάλλων μπορεί να εισάγει τεχνουργήματα ή ψευδή χαρακτηριστικά στην εικόνα, καθιστώντας δύσκολη την ακριβή ερμηνεία της πραγματικής δομής της πρωτεΐνης. Δεύτερον, η διαδικασία χρώσης μπορεί να είναι ανομοιόμορφη, οδηγώντας σε ελλιπείς ή στρεβλές αναπαραστάσεις του σχήματος της πρωτεΐνης. Τέλος, η διαδικασία προετοιμασίας του δείγματος μπορεί να εισάγει μεταβλητότητα, πράγμα που σημαίνει ότι μικρές αλλαγές στην τεχνική μπορούν να επηρεάσουν την τελική ποιότητα της εικόνας.
Μία από τις συνδεδεμένες μελέτες για την υποστήριξη αυτής της διαδικασίας δείχνει πόσο στρεβλές είναι πραγματικά οι αρχικές ακατέργαστες εικόνες και λεπτομέρειες της TEM. Σημειώστε πώς οι ερευνητές χειρίζονται την αντίθεση και άλλες παραμέτρους μέχρι να επιτύχουν το επιθυμητό σχήμα για το τρισδιάστατο μοντέλο τους.
Αυτό εγείρει την ανησυχία ότι αυτό που παρουσιάζεται ως «αντισώματα» μπορεί απλώς να είναι στρεβλώσεις από τη διαδικασία TEM που τονίζονται επιλεκτικά από τους ερευνητές. Αξίζει να σημειωθεί ότι οι συντάκτες της μελέτης παραδέχτηκαν ότι τα «αντισώματα» είναι φυσικά δυναμικά, κυμαίνονται συχνά και είναι δομικά ετερογενή. Δεδομένου ότι είναι δομικά πολύ διαφορετικά και όχι ομοιόμορφα, οι συγγραφείς παραδέχτηκαν ότι αυτό καθιστά δύσκολη τη μελέτη της δομής και της λειτουργίας χρησιμοποιώντας τις τρέχουσες τεχνολογίες όπως η κρυσταλλογραφία ακτίνων Χ, ο πυρηνικός μαγνητικός συντονισμός (NMR), ακόμη και η ανακατασκευή ενός σωματιδίου EM, επειδή όλες αυτές οι τεχνικές χρειάζονται το μέσο σήμα από χιλιάδες έως εκατομμύρια μεμονωμένα σωματίδια για να πάρουν μια «ακριβή» αναπαράσταση.
2.7. Βελτιστοποιημένη αρνητική χρώση (OpNS) για την απεικόνιση πρωτεΐνης
Η OpNS προσφέρει πλεονεκτήματα σε σχέση με την παραδοσιακή NS, το οποίο συνήθως παρέχει εικόνες σχετικά χαμηλής ανάλυσης όπου οι αλληλεπιδράσεις χρώσης-πρωτεϊνών μπορεί να προκαλέσουν τεχνουργήματα όπως συσσωμάτωση, ισοπέδωση και στοίβαξη [42,43,44]. Για παράδειγμα στις λιποπρωτεΐνες [35,45,46,47,48,49,50,51,52], ένα κοινό τεχνούργημα που παράγεται είναι το rouleaux, όπου στοιβάζονται σωματίδια λιποπρωτεϊνών και συσσωρεύονται σε μια σειρά [53,54,55,56,57,58]. Για να ξεπεραστούν αυτά τα εμπόδια με τη μείωση του σχηματισμού τεχνουργημάτων και την αύξηση της ανάλυσης, έχει αναπτυχθεί ένα βελτιστοποιημένο πρωτόκολλο αρνητικής χρώσης (OpNS) [51,52,59,60,61,62,63,64,65,66,67,68,69]. Σε αυτές τις μελέτες, ένας συγκεκριμένος τύπος αντιδραστηρίου χρώσης (όπως μυρμηκικό ουρανύλιο, UF) και σχετικά χαμηλή συγκέντρωση αλάτων προσδιορίστηκαν ως βασικές παράμετροι για την αποφυγή σχηματισμού τεχνουργημάτων rouleaux, ενώ οι μέθοδοι πρόληψης έκθεσης στο φως και μικρού φιλτραρίσματος (0,02 μm) βρέθηκαν ως βασικές παράμετροι για τη λήψη εικόνων υψηλής ανάλυσης μικρών και ασύμμετρων πρωτεϊνών [31,52]. Η μεθοδολογία OpNS έχει χρησιμοποιηθεί για την εξέταση αρκετών πρωτεϊνών με γνωστή δομή, όπως η πρωτεΐνη μεταφοράς χοληστερυλεστέρα (CETP) [59], τα αντισώματα [31,60,61,62], το GroEL και το Protesome [63], και για τον προσδιορισμό της δομής άγνωστων πρωτεϊνών, όπως η σχετιζόμενη με επαφή πρωτεΐνη τύπου 2 (CNTNAP2) [64], η καλσυντενίνη-3 [65], το ζεύγος 84 βάσεων dsDNA συζευγμένο με νανοχρυσό 5 nm [66], το DNA origami [67], το σύμπλοκο λιποσώματος-CETP [68] και οι λιποπρωτεΐνες και οι μορφές τους όταν συνδέονται με ένα αντίσωμα [52,69,70,71]. Η επιτυχία στην απεικόνιση αυτών των μικρών πρωτεϊνών (40-200 kDa) παρέχει αποδείξεις ότι η μέθοδος OpNS είναι ένα χρήσιμο εργαλείο για την επέκταση των συμβατικών ορίων του ΗΜ προς τον προσδιορισμό μικρών και ασύμμετρων πρωτεϊνικών δομών, συμπεριλαμβανομένων των αντισωμάτων (Εικόνα 2).
Εικόνα 2. Οι εικόνες ηλεκτρονικής μικροσκοπίας βελτιστοποιημένης αρνητικής χρώσης (OpNS) (EM) των σωματιδίων αντισωμάτων IgG2. (A) Άποψη έρευνας των σωματιδίων αντισωμάτων IgG που απεικονίζονται από το OpNS EM. (Β) Αντιπροσωπευτικές εικόνες μεμονωμένων σωματιδίων του αντισώματος. (Γ) Μεγεθυμένες όψεις επιλεγμένων εικόνων μεμονωμένων σωματιδίων και (Δ) οι αντίστοιχες αποθορυβοποιημένες εικόνες τους συγκρίνονται με (Ε) την κρυσταλλική δομή σε συγκεκριμένο προσανατολισμό. Copyright© 2015 των συγγραφέων, με τη διαχείριση του Nature Publishing Group.
Η κρυο-ηλεκτρονική μικροσκοπία (cryo-EM) είναι μια τεχνική που χρησιμοποιείται για την απεικόνιση πρωτεϊνών και άλλων βιολογικών μορίων σε πολύ υψηλή ανάλυση με κατάψυξη του δείγματος. Οι πρωτεΐνες αιωρούνται σε ένα λεπτό στρώμα υγρού και στη συνέχεια καταψύχονται γρήγορα, το οποίο λέγεται ότι βοηθά στη διατήρηση της φυσικής δομής χωρίς την ανάγκη χρώσης ή άλλων θεραπειών που θα μπορούσαν να τις αλλάξουν, όπως παρατηρείται στις άλλες μεθόδους. Μόλις το δείγμα καταψυχθεί, μια δέσμη ηλεκτρονίων περνά μέσα από το δείγμα για να συλλάβει εικόνες των πρωτεϊνών, οι οποίες συνήθως λαμβάνονται από διαφορετικές γωνίες και στη συνέχεια συνδυάζονται χρησιμοποιώντας αλγόριθμους υπολογιστών για να δημιουργήσουν ένα 3D μοντέλο.
Είναι σημαντικό να σημειωθεί ότι οι εικόνες που παράγονται δεν είναι άμεσες εικόνες και εξακολουθούν να είναι μια ανακατασκευή 3D μοντέλου. Διάφοροι παράγοντες μπορούν να επηρεάσουν την ακρίβεια της τελικής αναπαράστασης, όπως ο σχηματισμός κρυστάλλων πάγου κατά τη διάρκεια της κατάψυξης, η έκθεση σε δέσμη ηλεκτρονίων που προκαλεί φυσαλίδες, η μόλυνση από πάγο και η ζημιά στα δείγματα και η πιθανή μεροληψία στη διαδικασία μοντελοποίησης του υπολογιστή. Άλλα ζητήματα περιλαμβάνουν την αναποτελεσματικότητα της Cryo-EM για την απεικόνιση πολύ μικρών πρωτεϊνών καθώς και την απαίτηση πολύ υψηλής ομοιογένειας δείγματος, γεγονός που αυξάνει τις δυσκολίες λήψης εικόνων υψηλής ανάλυσης εύκαμπτων πρωτεϊνών όπως τα «αντισώματα».
2.8. Κρυοηλεκτρονική μικροσκοπία (cryo-EM) για την απεικόνιση πρωτεϊνών
Κερδίζοντας το βραβείο Νόμπελ Χημείας το 2017 [72], ο James Dubochet ανέπτυξε το Cryo-EM, το οποίο είναι μια καθιερωμένη και όλο και πιο δημοφιλής μέθοδος που χρησιμοποιείται για την ανάλυση μεγάλων μορίων και συμπλόκων μορίων (συνήθως > ~100 kDa) σε ατομική ανάλυση [73]. Ο James Dubochet ανέπτυξε τη μέθοδο cryo-EM όπου τα δείγματα με ρυθμιστικό διάλυμα καταψύχονται γρήγορα με ένα λουτρό υγρού αιθανίου που ψύχεται με υγρό άζωτο. Ως αποτέλεσμα, τα μόρια του νερού με υποστηρικτικές μεμβράνες άνθρακα δεν μπορούν να σχηματίσουν ένα κρυσταλλικό πλέγμα πριν καταψυχθούν στην άμορφη μορφή ενός κρυστάλλου πάγου, επιτρέποντας στα βιομόρια του δείγματος να διατηρηθούν στη φυσική τους διαμόρφωση [74]. Ένα συμπληρωματικό πλεονέκτημα της κρυο-ΕΜ, σε σύγκριση με την κρυσταλλογραφία ακτίνων-Χ, είναι ότι η κρυο-ΕΜ επιτρέπει τη λήψη χιλιάδων εικόνων από πρωτεΐνες που δεν μπορούν εύκολα να σχηματιστούν σε μεγάλους κρυστάλλους. Πρόσφατα αναπτυγμένοι ανιχνευτές εικόνας υψηλού ρυθμού καρέ, όπως η κάμερα άμεσου ανιχνευτή Gatan K2, μπορούν να παρέχουν 10 φορές υψηλότερο ρυθμό καρέ από αυτόν των συμβατικών καμερών [75]. Ο υψηλός ρυθμός καρέ επιτρέπει την παρακολούθηση και τη διόρθωση της μετατόπισης των εικόνων cryo-EM και αυξάνει την αποτελεσματικότητα της ανίχνευσης σήματος για τη βελτίωση τόσο της αντίθεσης όσο και της ανάλυσης της εικόνας για μεγάλα μόρια [76].
Η κρυοαρνητική χρώση (cryo-NS) και η κρυοθετική χρώση (cryo-PS) είναι παραλλαγές των τεχνικών αρνητικής και θετικής χρώσης που χρησιμοποιούνται στην απεικόνιση TEM. Στην κρυο-NS, όπως και στην κανονική αρνητική χρώση, το δείγμα πρωτεΐνης αναμιγνύεται με τη χρώση βαρέων μετάλλων για να δημιουργήσει αντίθεση. Η βασική διαφορά εδώ είναι ότι το δείγμα καταψύχεται γρήγορα για να διατηρηθεί η δομή του. Ωστόσο, ακόμη και με το πρόσθετο βήμα κατάψυξης, η χρώση βαρέων μετάλλων μπορεί ακόμα να προκαλέσει παραμορφώσεις ή να εισαγάγει τεχνουργήματα, τα οποία επηρεάζουν την ακρίβεια της τελικής εικόνας.
Για το cryo-PS, η χρώση συνδέεται απευθείας με την πρωτεΐνη, κάνοντάς την να φαίνεται πιο σκούρα στην εικόνα και το δείγμα καταψύχεται επίσης γρήγορα για να βοηθήσει στη διατήρηση της φυσικής του δομής. Παρά ταύτα, παραμένει ο κίνδυνος αλλοίωσης της δομής της πρωτεΐνης λόγω της χρώσης, πράγμα που σημαίνει ότι η ακρίβεια της εικόνας μπορεί ακόμη να τεθεί σε κίνδυνο. Ενώ η διαδικασία κατάψυξης λέγεται ότι συμβάλλει στη διατήρηση της δομής της πρωτεΐνης πιο αποτελεσματικά από τις συνήθεις μεθόδους χρώσης, τόσο η cryo-NS όσο και η cryo-PS μπορούν ακόμη να εισάγουν τεχνουργήματα ή παραμορφώσεις. Ως αποτέλεσμα, οι ατελείς εικόνες και τα προκατειλημμένα μοντέλα που παράγονται μπορεί να μην αντιπροσωπεύουν πλήρως τον τρόπο με τον οποίο οι πρωτεΐνες υπάρχουν στη φύση. Οι συγγραφείς επισημαίνουν ότι μια σημαντική πρόκληση με αυτές τις μεθόδους είναι ότι μπορούν να εξαλείψουν μόνιμα τις δομικές πληροφορίες, γεγονός που καθιστά δύσκολη την απεικόνιση μικρών πρωτεϊνών, όπως τα «αντισώματα», με τη χρήση αυτών των μεθόδων. Δηλώνουν ότι πρέπει να αναπτυχθεί μια εναλλακτική μέθοδος για τη μελέτη μικρών πρωτεϊνών
2.9. Κρυοαρνητική χρώση (cryo-NS) και κρυοθετική χρώση (cryo-PS) για απεικόνιση πρωτεϊνών
Οι Cryo-NS και cryo-PS βοηθούν στην ενίσχυση των εικόνων χαμηλής αντίθεσης των μη χρωματισμένων βιολογικών σωματιδίων που απεικονίζονται με την παραδοσιακή κρυο-EM, ιδίως για μικρές πρωτεΐνες (<100 kDa). Η υψηλή αποεστίαση (συνήθως αρκετά μm) χρησιμοποιείται συνήθως για τη μερική ενίσχυση της αντίθεσης των σωματιδίων, αν και αυτό εξαλείφει ένα ορισμένο ποσοστό δομικών πληροφοριών. Εν συντομία, υπό υψηλότερη αποεστίαση, η ταλάντωση του πλάτους διασχίζει το μηδέν πιο συχνά και, ως αποτέλεσμα, η συνέλιξη μεταξύ της συνάρτησης μεταφοράς αντίθεσης (CTF) και της δομής θα προκαλούσε την οριστική εξάλειψη ενός αυξημένου ποσοστού δομικών πληροφοριών, περιορίζοντας την απεικόνιση για μικρές πρωτεΐνες. Ως αποτέλεσμα, οι μικρές πρωτεΐνες είναι δύσκολο να μελετηθούν με τη χρήση αυτής της συνθήκης.
Μια εναλλακτική προσέγγιση για την απεικόνιση είναι σε μεγάλο βαθμό απαραίτητη για τον προσδιορισμό της δομής των μικρών πρωτεϊνών. Οι Adrian et al. πρότειναν μια προσέγγιση που συνδυάζει την αρνητική χρώση με την κρυο-EM, που ονομάζεται κρυο-αρνητική χρώση (cryo-NS), για να ξεπεραστεί η χαμηλή αντίθεση υπό συνθήκες στενότερης εστίασης [77]. Σε αυτή τη μέθοδο, το πλέγμα cryo-EM πλένεται γρήγορα με διάλυμα μολυβδαινικού αμμωνίου 16% πριν καταψυχθεί γρήγορα σε λουτρό υγρού αιθανίου. Οι εικόνες cryo-NS έδειξαν λεπτή δομική λεπτομέρεια και το συνολικό σχήμα σωματιδίων ήταν συνεπές με την ακηλίδωτη εικόνα cryo-EM, υποστηρίζοντας τα πλεονεκτήματα της μεθόδου.
Ως εναλλακτική προσέγγιση στην κρυο-NS, κρυοθετική χρώση (cryo-PS) αναφέρθηκε από τους Zhang et al. για άμεση απεικόνιση της δομής υψηλής ανάλυσης των πρωτεϊνών που απεικονίζονται υπό συνθήκες κοντινής εστίασης [51,52]. Για παράδειγμα, οι εικόνες κρυο-PS υψηλής ανάλυσης των 53 kDa CETP περιέχουν αξιοσημείωτες δευτερογενείς δομικές λεπτομέρειες ενός μεμονωμένου μορίου (Σχήμα 3 Β) [6,59]. Η μέθοδος cryo-PS αναπτύχθηκε συνδυάζοντας την OpNS με τα συμβατικά πρωτόκολλα cryo-EM. Αντί για 16% μολυβδαινικό αμμώνιο, 1% μυρμηκικό ουρανύλιο (UF) χρησιμοποιήθηκε ως αντιδραστήριο χρώσης. Δεδομένου ότι η εικόνα cryo-PS έδειξε μια αντίστροφη αντίθεση εικόνας σε σχέση με εκείνη του πρωτοκόλλου cryo-NS και συνεπή αντίθεση με εκείνη της συμβατικής εικόνας cryo-EM, ονομάστηκε cryo-PS. Οι εικόνες κρυο-PS υψηλής ανάλυσης πρότειναν ότι το UF διεισδύει στη μοριακή επιφάνεια, γεγονός που αμφισβητεί τη συμβατική κατανόηση ότι η χρώση μπορεί να συμβεί μόνο στην εξωτερική επιφάνεια της πρωτεΐνης. Ο μηχανισμός διείσδυσης του UF στη μοριακή επιφάνεια είναι άγνωστος. Μια πιθανότητα είναι ότι το κατιόν ουρανυλίου συνδέεται με τις διαθέσιμες πρωτεϊνικές καρβοξυλομάδες για να ενισχύσει τη σκέδαση ηλεκτρονίων, η οποία είναι παρόμοια με τη μέθοδο πολλαπλής ισομορφικής αντικατάστασης (MIR) στην κρυσταλλογραφία ακτίνων Χ [78,79,80]. Το πρωτόκολλο cryo-PS είναι μια κατάλληλη εφεδρική μέθοδος για το cryo-ET και μπορεί να εφαρμοστεί για τη μελέτη ενός μεμονωμένου μακρομορίου σε διάλυμα, όπως το DNA origami [67].
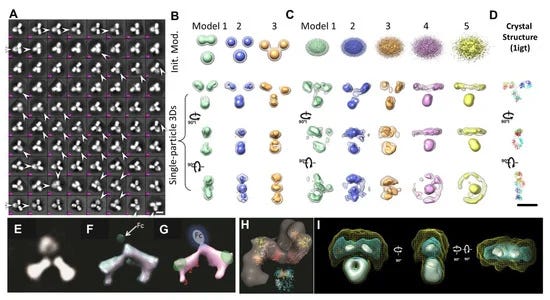
Εικόνα 3. Τα τεχνουργήματα που εμφανίζονται στις μέσες 2D εικόνες και 3D ανακατασκευές εύκαμπτων σωματιδίων αντισωμάτων. (A) Οι ασαφείς περιοχές που υποδεικνύονται με βέλη στους επιλεγμένους μέσους όρους κατηγορίας 2D χωρίς αναφορά εικόνων αντισωμάτων (συνολικά 11.373 σωματίδια). Ράβδοι: 100 Å. (B) Η αρχική μεροληψία του μοντέλου και τα τεχνουργήματα στις 3D ανακατασκευές ενός σωματιδίου του αντισώματος IgG. Τα αρχικά μοντέλα αντισωμάτων με τρεις σφαιρικές περιοχές έδειξαν την μεροληψία τους στις θέσεις των περιοχών στην τελική 3D ανακατασκευή. (C) Ενώ χρησιμοποιήθηκαν ελλειψοειδή Gaussian ως αρχικά μοντέλα χωρίς προκατάληψη, οι τελικές 3D εικόνες έδειξαν λανθασμένες δομές από το (D) σε σύγκριση με την κρυσταλλική δομή. Πνευματικά δικαιώματα© 2015 οι συγγραφείς που διαχειρίζεται η Nature Publishing Group. (Ε) Ένας παρόμοιος θολός 2D μέσος όρος ήταν επίσης εμφανής στα μόρια IgG διπλής μεταβλητής περιοχής. (F–H) Η 3D ανακατασκευή ενός σωματιδίου (μέσος όρος σωματιδίων) έδειξε ότι η περιοχή Fc εξαλείφθηκε. Πνευματικά δικαιώματα© 2013 Landes Bioscience. (I) Οι μέσοι όροι εκατό υποόγκων 3D ανακατασκευών σωματιδίων αντισωμάτων μπορούν επίσης να εξαλείψουν τις περιοχές. Πνευματικά δικαιώματα© 2015 οι συγγραφείς που διαχειρίζεται η Nature Publishing Group.
Η κρυσταλλογραφία ηλεκτρονίων είναι μια ακόμη μέθοδος που χρησιμοποιείται για τον προσδιορισμό της 3D δομής των πρωτεϊνών και το κάνει αναλύοντας πώς αλληλεπιδρούν τα ηλεκτρόνια με ένα κρυσταλλικό δείγμα. Με αυτή την τεχνική, οι πρωτεΐνες υποστηρίζεται ότι είναι διατεταγμένες σε ένα κανονικό, επαναλαμβανόμενο κρυσταλλικό πλέγμα και μια δέσμη ηλεκτρονίων περνά μέσα από τον κρύσταλλο που σκεδάζεται και δημιουργεί ένα μοτίβο περίθλασης που καταγράφεται. Αυτό είναι παρόμοιο με αυτό που περιγράφηκε τόσο στην κρυσταλλογραφία ακτίνων Χ όσο και στις μεθόδους περίθλασης από πριν. Χρησιμοποιώντας διάφορους αλγόριθμους υπολογιστών, τα καταγεγραμμένα μοτίβα περίθλασης από διαφορετικές γωνίες συνδυάζονται για να ανακατασκευαστεί ένα 3D μοντέλο της δομής της πρωτεΐνης.
Υπάρχουν αρκετοί περιορισμοί σε αυτή τη διαδικασία που θέτουν σε αμφισβήτηση την ακρίβεια των εικόνων και των μοντέλων που παράγονται. Υπάρχει η απαίτηση η πρωτεΐνη να σχηματίζει καλά οργανωμένους κρυστάλλους και μπορεί να προκύψουν παραμορφώσεις κατά τη διαδικασία κρυστάλλωσης. Επιπλέον, τα ηλεκτρόνια υψηλής ενέργειας μπορούν να προκαλέσουν βλάβη ακτινοβολίας σε δείγματα 2D, γεγονός που μπορεί να οδηγήσει στη δημιουργία τεχνουργημάτων ή παραμορφώσεων από τις αλληλεπιδράσεις με τη δέσμη ηλεκτρονίων, επηρεάζοντας την ακρίβεια του τελικού 3D μοντέλου. Όπως και με τις άλλες μεθόδους, το τελικό 3D μοντέλο εξακολουθεί να είναι μια ανακατασκευή που βασίζεται σε έμμεσες μετρήσεις και μπορεί να μην αντιπροσωπεύει τέλεια την πραγματική δομή της πρωτεΐνης όπως υπάρχει στη φύση.
2.10. Κρυσταλλογραφία ηλεκτρονίων για 3D ανακατασκευή πρωτεϊνών
Η ηλεκτρονική κρυσταλλογραφία είναι η πρώτη τεχνική TEM που έχει χρησιμοποιηθεί για τον προσδιορισμό της δομής ατομικής ανάλυσης των πρωτεϊνών, ειδικά των μεμβρανικών πρωτεϊνών ενσωματωμένων στη λιπιδική διπλοστιβάδα [81,82]. Αυτή η τεχνική απαιτεί οι πρωτεΐνες να προσανατολίζονται σε 2D συστοιχία. Μέσω της συγχώνευσης των περιθλάσεων ηλεκτρονίων και των εικόνων προβολής που αποκτήθηκαν από διαφορετικές γωνίες κλίσης, μπορεί να προσδιοριστεί η δομή ατομικής ανάλυσης των πρωτεϊνών. Ο περιορισμός αυτής της προσέγγισης είναι παρόμοιος με την κρυσταλλογραφία ακτίνων Χ, στην οποία απαιτείται επαρκής κρυστάλλωση πρωτεϊνών.
Η 3D ανακατασκευή ενός σωματιδίου για τον μέσο όρο της 3D δομής είναι μια μέθοδος όπου οι πρωτεΐνες τοποθετούνται σε μια επιφάνεια και μια σειρά εικόνων από διαφορετικές γωνίες λαμβάνονται χρησιμοποιώντας ένα ηλεκτρονικό μικροσκόπιο. Για να λειτουργήσει αυτή η μέθοδος, το δείγμα πρέπει να είναι ομοιογενές (δηλαδή να αποτελείται από πανομοιότυπα σωματίδια). Ωστόσο, δεδομένου ότι οι πρωτεΐνες μπορεί να διαφέρουν ως προς το σχήμα, τον προσανατολισμό και τη φυσική τους ευκαμψία, κάθε εικόνα μπορεί να φαίνεται διαφορετική. Έτσι, πρέπει να αναλυθούν και να ευθυγραμμιστούν χιλιάδες έως δεκάδες χιλιάδες εικόνες σωματιδίων για να εξαλειφθούν κατά μέσο όρο αυτές οι διαφορές, προκειμένου να δημιουργηθεί ένα συνεπές τρισδιάστατο μοντέλο.
Ένα βασικό μειονέκτημα αυτής της μεθόδου είναι ότι δεν μπορεί να χρησιμοποιηθεί για τον προσδιορισμό νέων ή καινοφανών δομών. Για παράδειγμα, η επαλήθευση της δομής σχήματος Υ των «αντισωμάτων» θα απαιτούσε προηγούμενο καθαρισμό και απομόνωση αυτών των σωματιδίων. Οι συγγραφείς αναγνωρίζουν ότι δεν υπάρχουν οριστικά κριτήρια που να επιβεβαιώνουν ότι τα σωματίδια μοιράζονται την ίδια δομή πριν από τον μέσο όρο και την ταξινόμηση. Αυτή η μέθοδος βασίζεται σε υποθέσεις, όπως οι διαφορές μεταξύ των σωματιδίων που οφείλονται σε τυχαίο θόρυβο ή διακυμάνσεις στον προσανατολισμό, και ότι τα σωματίδια έχουν μία ή λίγες διακριτές ταυτόσημες διαμορφώσεις. Αυτές οι υποθέσεις μπορούν να εισάγουν μεροληψία στη διαδικασία μοντελοποίησης. Ως αποτέλεσμα, το τελικό 3D μοντέλο είναι μια ανακατασκευή με τη βοήθεια υπολογιστή και μπορεί να μην αντιπροσωπεύει πλήρως την πραγματική δομή της πρωτεΐνης όπως υπάρχει στη φύση.
2.11. Τρισδιάστατη -3D ανακατασκευή ενός σωματιδίου για τον μέσο όρο της 3D δομής της πρωτεΐνης
Μαζί με την cryo-EM, η 3D ανακατασκευή ενός σωματιδίου για τον μέσο όρο της 3D δομής μιας πρωτεΐνης ήταν επίσης θέμα του βραβείου Νόμπελ Χημείας του 2017 και αναπτύχθηκε και χρησιμοποιήθηκε με ταχείς ρυθμούς για τον προσδιορισμό της δομής πρωτεϊνών σε ατομική ανάλυση τις τελευταίες δύο δεκαετίες. Αν και ονομάστηκε "μονοσωματιδιακή", η 3D δομή που λαμβάνεται δεν προέρχεται από ένα μόνο ή ένα μεμονωμένο σωματίδιο, αλλά κατά μέσο όρο από χιλιάδες έως δεκάδες χιλιάδες διαφορετικά σωματίδια. Το πλεονέκτημα της 3D ανακατασκευής ενός σωματιδίου είναι ο προσδιορισμός της μοριακής δομής χωρίς προηγούμενη απαίτηση κρυστάλλωσης. Επομένως, η δομή είναι πιο πιθανό να βρίσκεται στη φυσική της κατάσταση, αντί για τη στερεά κατάσταση που χρησιμοποιείται για την κρυσταλλογραφία ακτίνων Χ. Οι πρόσφατες εξελίξεις στην τεχνολογία άμεσων ανιχνευτών για τη λήψη εικόνων υψηλής αντίθεσης [75] και η βελτίωση των αλγορίθμων λογισμικού υπολογιστών [81,82] για την ακριβή ταξινόμηση και μέσο όρο επιτρέπουν τώρα τον προσδιορισμό των πρωτεϊνικών δομών σε ατομική ανάλυση [72]. Η μέθοδος έχει επίσης χρησιμοποιηθεί για τη μελέτη της 3D δομής αντισωμάτων [83,84]. Τα μειονεκτήματα της μεθόδου περιλαμβάνουν i) το δείγμα πρέπει να είναι σχετικά ομοιογενές· ii) θεωρήθηκε ότι τα σωματίδια μοιράζονται μία ή λίγες διακριτές ταυτόσημες διαμορφώσεις· iii) η 3D ανακατασκευή εξαρτάται από το αρχικό μοντέλο [85], όπως αυτό που απεικονίζεται στο (σχήμα 3B) [60]· iv) η φυσική δυναμική της πρωτεΐνης μπορεί να χαρακτηριστεί εσφαλμένα [76]· v) οι 2D προβολές/εικόνες δεν είναι ευαίσθητες και ανεπαρκείς για τη χρήση τους για τη διάκριση της διαμόρφωσης σε 3D, όπως τα δεξιά και τα αριστερά αντικείμενα [31]· vi) δεν μπορούν να χρησιμοποιηθούν κριτήρια για να κριθεί με βεβαιότητα εάν τα σωματίδια είχαν την ίδια δομή πριν από τον υπολογισμό του μέσου όρου και την ταξινόμηση· vii) πιθανά τεχνουργήματα μπορούν να παραχθούν στην τρισδιάστατη ανακατασκευή του εύκαμπτου τμήματος (Σχήμα 3 Α,Ε) [30]· viii) είναι δύσκολο να χαρακτηριστούν απροσδόκητα μικρές διαστάσεις (σχήμα 3ΣΤ–Η) [30]· ix) ορισμένοι τομείς μπορούν να εξαλειφθούν (σχήμα 3H) [84]· ή (x) οι αναλύσεις μπορεί να είναι άνισης κατανομής [83,84]. Οι απούσες περιοχές/τομείς μπορούν ακόμη και να παρουσιαστούν σε μια σχεδόν ατομική ανάλυση 3D ανακατασκευής ενός σωματιδίου, όπως οι περιοχές αγκυρίνης που εξαφανίστηκαν στην ατομική δομή του TRPV1 [76].
Η ηλεκτρονική τομογραφία μονού σωματιδίου (ET) είναι μια μέθοδος όπου ένα δείγμα που περιέχει πρωτεΐνες απεικονίζεται με τη χρήση ηλεκτρονικού μικροσκοπίου από πολλαπλές γωνίες με σταδιακή κλίση. Η διαδικασία αυτή δημιουργεί μια σειρά από δισδιάστατες εικόνες, οι οποίες στη συνέχεια συνδυάζονται με τη χρήση εξειδικευμένου λογισμικού για την ανακατασκευή ενός τρισδιάστατου μοντέλου της πρωτεΐνης.
Ωστόσο, όπως και άλλες τεχνικές απεικόνισης, η ΕΤ έχει τους περιορισμούς της. Η μεταβλητότητα στον προσανατολισμό της πρωτεΐνης, ο θόρυβος και άλλοι παράγοντες μπορούν να επηρεάσουν την ποιότητα του τελικού τρισδιάστατου μοντέλου. Η ετερογένεια του δείγματος, η οποία είναι κοινή σε εκείνα που λέγεται ότι περιέχουν «αντισώματα», μπορεί να οδηγήσει σε διαταραχές από σημαντικό θόρυβο, τεχνουργήματα σφήνας που λείπουν και την εισαγωγή συστηματικών σφαλμάτων ανακατασκευής, τα οποία επηρεάζουν την ακρίβεια της ευθυγράμμισης και της ταξινόμησης των υποόγκων. Τα σφάλματα στην ταξινόμηση και την ευθυγράμμιση μπορούν να επηρεάσουν περαιτέρω την ποιότητα και την ανακρίβεια της τρισδιάστατης μέσης ανάλυσης. Επιπλέον, η ταξινόμηση των σωματιδίων σε περιορισμένο αριθμό ομάδων επιτυγχάνεται μέσω ανθρώπινης απόφασης, η οποία, όπως σημειώνουν οι συγγραφείς, εισάγει υποκειμενικότητα και προκατάληψη που περιορίζει την αντικειμενική κατανόηση της φυσικής δυναμικής και της κατάστασης ισορροπίας των πρωτεϊνών σε διάλυμα. Ως αποτέλεσμα, το τελικό μοντέλο εξακολουθεί να αντιπροσωπεύει μια ανακατασκευή με τη βοήθεια υπολογιστή και όχι μια άμεση εικόνα της πρωτεΐνης, η οποία μπορεί να μην αντικατοπτρίζει τη φυσική κατάσταση αυτού που απεικονίζεται.
2.12. Ηλεκτρονική τομογραφία ενός σωματιδίου (ET) για υποόγκο, μέση 3D δομή πρωτεϊνών
Η ηλεκτρονική τομογραφία (ET) είναι μια μέθοδος που έχει χρησιμοποιηθεί για τη μελέτη της δομής ενός μεγάλου αντικειμένου μίας μόνο περίπτωσης, όπως το τμήμα ενός κυττάρου ή ενός βακτηρίου, παράγοντας μια εικόνα από μια σειρά γωνιών θέασης [86,87].Ο τρισδιάστατος χάρτης πυκνότητας ανακατασκευάστηκε από αυτές τις κεκλιμένες εικόνες από έναν αλγόριθμο υπολογιστή. Η ανάλυση της ανακατασκευής του ET 3D πιστεύεται ότι είναι πολύ χαμηλή για να χρησιμοποιηθεί για τον χαρακτηρισμό της δομής και της δυναμικής των πρωτεϊνών [88]. Για να βελτιωθεί η ανάλυση 3D ανακατασκευής, προτάθηκε μια λύση παράκαμψης, στην οποία εκατοντάδες έως χιλιάδες υποόγκοι που περιείχαν ένα μόνο σωματίδιο πρωτεΐνης ευθυγραμμίστηκαν και υπολογίστηκαν κατά μέσο όρο σε έναν ενιαίο τρισδιάστατο χάρτη πυκνότητας [89]. Αυτή η προσέγγιση έδειξε τη χρησιμότητά της για την απεικόνιση πρωτεϊνών που είναι δομικά ομοιογενείς με συμμετρία [88,90], συμπεριλαμβανομένου του GroEL [91]. Οι μέσοι όροι των υποόγκων μπορούν να μειώσουν τον τρισδιάστατο θόρυβο και να συμπληρώσουν το τεχνούργημα της σφήνας που λείπει, ώστε να επιτευχθεί σχεδόν ατομική ανάλυση για την τρισδιάστατη ανακατασκευή [92]. Ωστόσο, για πρωτεΐνες με σημαντική ασύμμετρη και δομική ετερογένεια, η ακρίβεια της ευθυγράμμισης και της ταξινόμησης αυτών των υποόγκων μπορεί να διαταραχθεί από σημαντικό θόρυβο, το τεχνούργημα ελλείπουσας σφήνας και την εισαγωγή συστηματικών σφαλμάτων ανακατασκευής [89]. Τα σφάλματα στην ταξινόμηση και την ευθυγράμμιση μπορούν να επηρεάσουν περαιτέρω την ποιότητα του μέσου όρου 3D [31]. Επιπλέον, για μια συνεχώς μεταβαλλόμενη δομή, η ταξινόμηση των σωματιδίων σε περιορισμένο αριθμό ομάδων επιτυγχάνεται μέσω της ανθρώπινης απόφασης, η οποία εισάγει υποκειμενικότητα και προκατάληψη που περιορίζει την αντικειμενική κατανόηση της φυσικής δυναμικής και της κατάστασης ισορροπίας των πρωτεϊνών σε διάλυμα. Για παράδειγμα, ένας μέσος τρισδιάστατος χάρτης από εκατό υποογκώδεις τρισδιάστατες ανακατασκευές σωματιδίων αντισωμάτων θα περιείχε τεχνουργήματα, όπως η συρρίκνωση του μεγέθους των περιοχών Fab (Σχήμα 3I) [60].
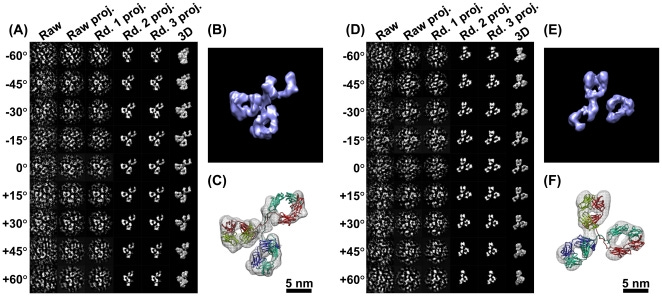
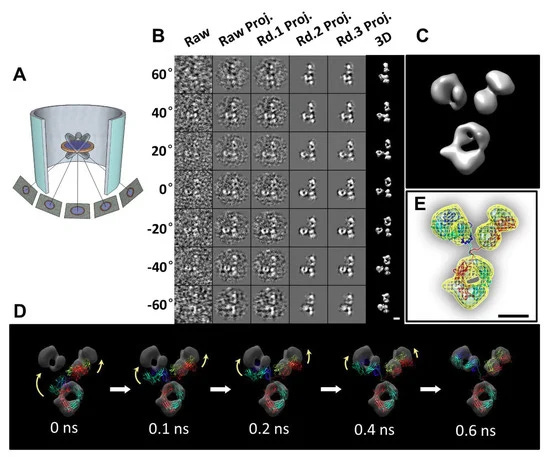
Η Ηλεκτρονική Τομογραφία Μεμονωμένων Σωματιδίων (IPET) είναι η κύρια μέθοδος στην οποία εστιάζουν οι συγγραφείς της παρούσας εργασίας. Πρόκειται για μια παραλλαγή της ηλεκτρονικής τομογραφίας που επιχειρεί να ανακατασκευάσει τρισδιάστατες δομές μεμονωμένων μορίων σε υψηλή ανάλυση. Σε αυτή τη μέθοδο, υποστηρίζεται ότι ένα μεμονωμένο πρωτεϊνικό μόριο απεικονίζεται με τη χρήση ηλεκτρονικού μικροσκοπίου από πολλαπλές γωνίες προκειμένου να προσπαθήσει να αποτυπώσει διαφορετικές προοπτικές. Όπως και προηγουμένως, οι διάφορες εικόνες 2D ευθυγραμμίζονται και συνδυάζονται με τη χρήση ενός αλγορίθμου τρισδιάστατης ανακατασκευής μέσω υπολογιστή, γνωστού ως ανακατασκευή εστιασμένης ηλεκτρονικής τομογραφίας (FETR), για να παραχθεί ένα τρισδιάστατο μοντέλο της πρωτεΐνης.
Ωστόσο, όπως έχει συζητηθεί με άλλες τεχνικές ηλεκτρονικής μικροσκοπίας, το IPET έχει τους περιορισμούς του. Το ίδιο σημαντικό ζήτημα ισχύει στο ότι η φυσική δομή της πρωτεΐνης μπορεί να επηρεαστεί από τις διαδικασίες απεικόνισης και προετοιμασίας δειγμάτων, όπως η κατάψυξη ή η χρώση, καθώς αυτές οι διαδικασίες μπορούν να εισάγουν τεχνουργήματα ή παραμορφώσεις. Επιπλέον, όπως σημειώθηκε προηγουμένως, οι πρωτεΐνες όπως τα «αντισώματα» λέγεται ότι είναι εύκαμπτες και μπορούν να υπάρχουν σε διάφορες διαμορφώσεις, καθιστώντας δύσκολη την ακριβή ανακατασκευή μιας ενιαίας, οριστικής δομής. Ο θόρυβος και άλλες μεταβλητές, όπως τα ελλιπή δεδομένα λόγω ελλιπών αντικειμένων σφήνας, μπορούν να παραμορφώσουν περαιτέρω τις 3D ανακατασκευές. Τελικά, το τελικό 3D μοντέλο εξακολουθεί να είναι μια ανακατασκευή με τη βοήθεια υπολογιστή και όχι μια άμεση αναπαράσταση του υποτιθέμενου «αντισώματος» όπως υπάρχει στο φυσικό του περιβάλλον. Αυτό αφήνει περιθώρια για ανακρίβειες και υποθέσεις στο τελικό μοντέλο.
2.13. Ηλεκτρονική τομογραφία μεμονωμένων σωματιδίων (IPET) για δομή 3D πρωτεΐνης ενός μορίου
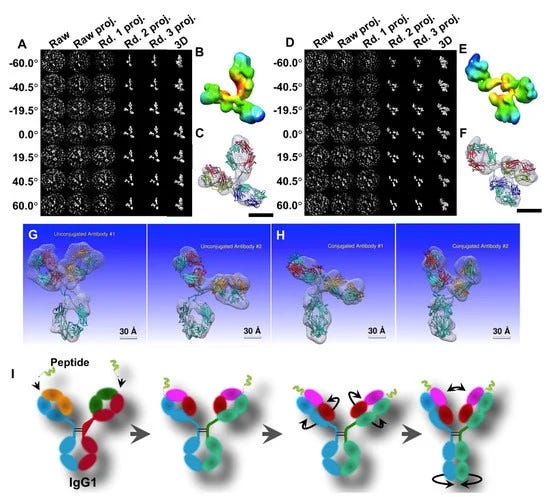
Η IPET είναι μια πειραματική προσέγγιση που μπορεί να προσδιορίσει την 3D δομή ενός μεμονωμένου σωματιδίου σε ανάλυση νανομέτρου, ανοίγοντας τη δυνατότητα να αποκαλυφθεί η πραγματική, ακριβέστερη δυναμική φύση και οι διακυμάνσεις των μορίων στο διάλυμα (Σχήμα 4) [6,8,18,34,60 ]. Σε σύγκριση με τη συμβατική 3D ανακατασκευή ενός σωματιδίου, η IPET είναι η πραγματική 3D ανακατασκευή ενός σωματιδίου που δεν απαιτεί ένα προκαθορισμένο μοντέλο, ούτε μέσο όρο από πολλαπλά μόρια. Αντίθετα, η παραδοσιακή 3D ανακατασκευή "ενός σωματιδίου" απαιτεί ένα αρχικό μοντέλο ή / και μέσο όρο από εκατοντάδες έως χιλιάδες σωματίδια για την επίτευξη μιας ενιαίας μέσης ανακατασκευής. Επιπλέον, η IPET μπορεί να ανεχθεί τα μικρά σφάλματα κλίσης ή τις μεγάλης κλίμακας παραμορφώσεις εικόνας που συχνά συνοδεύουν την ενδιάμεση ανάλυση (1-5 nm) μεμονωμένων δομικών «στιγμιότυπων» μορίων [31]. Η IPET βελτιώνει την ποιότητα της 3D ανακατασκευής μέσω διαφόρων τεχνικών βελτιώσεων τροποποιώντας το πρωτόκολλο για την προετοιμασία δειγμάτων (συμπεριλαμβανομένου του OpNS [51,63]), των μεθόδων για τον έλεγχο της απόκτησης δεδομένων [93], του αλγορίθμου 3D ανακατασκευής [31], και τις διορθώσεις για τη σφήνα που λείπει. Για να αποφευχθεί η επίδραση της παραμόρφωσης της εικόνας και των σφαλμάτων γωνίας κλίσης, ο αλγόριθμος ανακατασκευής (που ονομάζεται ανακατασκευή εστιασμένης ηλεκτρονικής τομογραφίας (FETR)) μειώνει το μέγεθος ανακατασκευής για την ακριβή ευθυγράμμιση των εικόνων κλίσης κάτω από σύνολα δυναμικών φίλτρων και μαλακών οριακών μασκών μέσω τοπικής επανάληψης βελτίωσης [31]. Η IPET έχει χρησιμοποιηθεί για τη μελέτη εύκαμπτων πρωτεϊνών ενσωματωμένων τόσο σε υαλοποιημένο πάγο (κρυο-ηλεκτρονική μικροσκοπία, cryo-EM) όσο και σε ιόντα βαρέων μετάλλων (αρνητική χρώση, NS). Οι 3D ανακατασκευές IPET από cryo-ET περιλαμβάνουν 17 nm εκκολαπτόμενα σωματίδια HDL [31], 53 kDa CETP δεσμευμένα σε λιποσώματα [68], DNA origami [67] και λιποπρωτεΐνες πολύ χαμηλής πυκνότητας με τα σύμπλοκα δέσμευσης αντισωμάτων τους [69] στην περιοχή διακριτικής ικανότητας από 3 έως 10 nm. Οι 3D ανακατασκευές IPET ελήφθησαν με επιτυχία από εικόνες OpNS υψηλής αντίθεσης, συμπεριλαμβανομένων 53 kDa CETP, σωματιδίων 150 kDa IgG1 [31,60,61], συζευγμάτων πεπτιδίου-αντισωμάτων [61], ζεύγους 84 βάσεων dsDNA δεσμευμένου σε σωματίδιο νανοχρυσού 5 nm [66], μονομερές καλσυντενίνης-3 (C3) 88 kDa [65], ένα 350 kDa C3 ολιγομερές [65], 135 kDa σχετιζόμενο με επαφή πρωτεΐνη 2 (CNTNAP2) [64], και συζεύγματα νανοχρυσού CNTNAP2 και 1,8 nm [64], συζεύγματα νανοχρυσού CNTNAP2 και 5 nm [64], σύμπλοκο CNTNAP2-αντισωμάτων [64] και μια Ν-τελική περιοχή 60 kDa του CNTNAP2 [64], στην οποία η ανάλυση μπορεί να βελτιωθεί έως και 1,2 nm.
Εικόνα 4. Μια 3D εικόνα ενός μεμονωμένου σωματιδίου αντισώματος IgG1 που ανακατασκευάστηκε με τομογραφία ηλεκτρονίων ατομικών σωματιδίων (IPET). (Α) Σχηματική απεικόνιση της ΕΤ ενός μεμονωμένου σωματιδίου πρωτεΐνης από μια σειρά γωνιών κλίσης. (Β) Η βήμα προς βήμα διαδικασία της IPET 3D δομής ενός μεμονωμένου σωματιδίου IgG1. (Γ) Η τελική 3D ανακατασκευή IPET. (Δ) Σύνδεση του δομικού μοντέλου με χρήση προσομοίωσης μοριακής δυναμικής. (Ε) Η τελική 3D ανακατασκευή IPET μιας καθορισμένης διαμόρφωσης της IgG1. Πνευματικά δικαιώματα© 2015 οι συγγραφείς που διαχειρίζεται η Nature Publishing Group.
Παρόλο που το IPET 3D δεν ήταν σε θέση να παρέχει δευτερεύοντα δομικά χαρακτηριστικά, εξακολουθεί να είναι επαρκές για να επιτρέψει την ευέλικτη σύνδεση της κρυσταλλικής δομής στο IPET 3D με προσομοίωση MD υπό συνθήκες περιορισμού χημικού δεσμού και ελαχιστοποίησης ενέργειας (Σχήμα 4D, E). Οι δομές που αποκαλύπτονται από αυτή τη συνδυασμένη προσέγγιση θα μπορούσαν να απαντήσουν σε ορισμένα σημαντικά βιολογικά ερωτήματα, όπως οι αλλαγές διαμόρφωσης των περιοχών IgG1 που προκαλούνται από τη σύζευξη πεπτιδίων [61]. Η IPET παρέχει μια συναρπαστική νέα ευκαιρία για τη μελέτη ετερογενών πρωτεϊνικών δομών, δυναμικών χαρακτηριστικών (Σχήμα 5) και διακυμάνσεων ισορροπίας παρακολουθώντας χημικές διαμορφωτικές αλλαγές και συμπεριφορές [71]. Μια ανασκόπηση από τους Ericus et al. [94] έχει περιγράψει τις δυσκολίες και τις λύσεις για την ηλεκτρομαγνητική ακτινοβολία όσον αφορά τόσο την έρευνα σκληρών όσο και μαλακών υλικών για 3D ανακατασκευή και οπτικοποίηση δομών υπο-νανομέτρων. Επιπλέον, αναφέρεται ότι πολλές μέθοδοι μπορούν να χρησιμοποιηθούν για να ξεπεραστούν οι περιορισμοί που βασίζονται σε δείγματα τόσο στις φυσικές όσο και στις βιολογικές επιστήμες με κίνητρο την καινοτομία και την προώθηση λύσεων μεγάλης κλίμακας με συνεργατικό τρόπο.
Εικόνα 5. Η δομική δυναμική IgG1 με ηλεκτρονική τομογραφία μεμονωμένων σωματιδίων (IPET). (A) 120 3D ανακατασκευές IPET από κάθε μεμονωμένο σωματίδιο IgG1 και τα συνδεδεμένα δομικά μοντέλα τους με χρήση προσομοίωσης μοριακής δυναμικής. (Β) Η επικάλυψη 120 δομικών μοντέλων που αποκαλύφθηκε από 120 μεμονωμένα μόρια, δείχνοντας τη διαφορά στις δομές. (Γ) Στατιστική ανάλυση των κατανομών γωνίας πεδίου και απόστασης. Πνευματικά δικαιώματα© 2015 οι συγγραφείς που διαχειρίζεται η Nature Publishing Group.
Το μέρος 3 επικεντρώνεται κυρίως στην προώθηση της IPET ως πειραματικής μεθόδου για την «ακριβή» απεικόνιση και ανακατασκευή ενός «αντισώματος». Ωστόσο, όπως και με τα προηγούμενα παραδείγματα σε αυτό το έγγραφο, δεν γίνεται καμία αναφορά στον τρόπο με τον οποίο ελήφθησαν τα υποτιθέμενα «αντισώματα» ή αν επιχειρήθηκε καθαρισμός και απομόνωση απευθείας από τον ορό πριν από την απεικόνιση. Αντ' αυτού, οι ερευνητές φαίνεται να επιλέγουν σωματίδια που θα μπορούσαν εύκολα να είναι τεχνουργήματα ή παραμορφώσεις, και από εκεί και πέρα, να κατασκευάζουν αφηγήσεις σχετικά με τη δομή και τη λειτουργία με βάση τις τρισδιάστατες ανακατασκευές.
3. Εφαρμογές της προσέγγισης ανακατασκευής IPET 3D στη μελέτη αντισωμάτων
3.1. Ποικιλία τρισδιάστατης δομής του αντισώματος IgG1 με IPET
Αν και άλλες μέθοδοι έχουν παράσχει ανεκτίμητα δομικά δεδομένα για αντισώματα και σύμπλοκα αντισώματος-αντιγόνου, το IPET μπορεί να απεικονίσει ένα μόνο μόριο σε 3D σε διάφορες διαμορφώσεις για να παρέχει πιο ουσιαστικά στοιχεία για τον καλύτερο χαρακτηρισμό της δυναμικής των αντισωμάτων. Μελέτες από τους Zhang et al. [60] περιέγραψαν καλύτερα την ευελιξία και τη διακύμανση της IgG1 χρησιμοποιώντας την ανακατασκευή IPET από εικόνες OpNS ET για να ληφθούν χάρτες πυκνότητας 3D μιας μεμονωμένης πρωτεΐνης σε ενδιάμεσες αναλύσεις (1-3 nm) (Σχήμα 4). Τέτοιες μελέτες δείχνουν ότι ο συνδυασμός IPET και OpNS μπορεί να επεκτείνει τις πειραματικές προσεγγίσεις στη δομική δυναμική φύση των αντισωμάτων της IgG1 (Εικόνα 5) [60]. Άλλες μελέτες έχουν επισημάνει την εφαρμοσιμότητα του χαρακτηρισμού IPET 3D της αλληλεπίδρασης σωματιδίων-σωματιδίων σε υαλοειδή πάγο, όπως αντισώματα δεσμευμένα σε λιποπρωτεΐνες πολύ χαμηλής πυκνότητας ανθρώπινου πλάσματος (VLDL) (Σχήμα 6) [69] και πρωτεΐνη μεταφοράς χολεστερυλεστέρα (CETP) σε λιποσώμα [68]. Στον τομέα της λιπιδικής έρευνας, το cryo-EM έχει προσδιορίσει την πολυεδρική 3D δομή υδρογενών σωματιδίων VLDL μέσω IPET και έχει χαρακτηρίσει την κατευθυντική δέσμευση της πρωτεΐνης μεταφοράς χοληστερυλεστέρα (CETP) σε HDL και VLDL για τη βελτίωση της κατανόησης του ρόλου του VLDL στην αθηρογένεση [69]. Τέτοιες μελέτες υπογραμμίζουν την πρακτικότητα της TEM παράλληλα με την IPET για την προώθηση της κατανόησης της δυναμικής αλληλεπίδρασης αντισωμάτων [69].
Εικόνα 6. Η IPET 3D δομή του IgG1 δεσμεύεται σε αντιγόνο σε υαλώδη πάγο. (Α) Εικόνες κρυο-ET της IgG αναμεμειγμένης με σωματίδια λιποπρωτεΐνης πολύ χαμηλής πυκνότητας (VLDL). (B–I) IPET Τρισδιάστατη -3D ανακατασκευή δύο συμπλόκων αντισωμάτων δεσμευμένων στο VLDL. Το δείγμα είναι ενσωματωμένο σε υαλώδη πάγο. (J,K) Έξι παρουσιαστικοί χάρτες IPET 3D από έξι μεμονωμένα σύμπλοκα αντισωμάτων-VLDL (η θέση των αντισωμάτων υποδείχθηκε σε μωβ χρώμα). Πνευματικά δικαιώματα© 2016 από την Αμερικανική Εταιρεία Βιοχημείας και Μοριακής Βιολογίας, Inc.
Η δυναμική των IgGs εξαρτάται από το μήκος των αρθρώσεων, τα μοτίβα SS των αρθρώσεων μεταξύ των ισοτύπων και τη σύζευξη και τη δέσμευση αντιγόνου για τον ίδιο ισότυπο. Οι αριθμοί των δισουλφιδικών δεσμών που βρίσκονται μεταξύ της άρθρωσης και των περιοχών της βαριάς αλυσίδας είναι 2 για τις ανθρώπινες IgG1 και IgG2, 4 για την IgG4 και 11 για την IgG3, αν και η καθεμία περιέχει συνολικά 12 ενδοαλυσιδωτούς δισουλφιδικούς δεσμούς. Κάθε δισουλφιδικός δεσμός σχετίζεται με μια μεμονωμένη περιοχή IgG- επομένως, η IgG3 έχει λιγότερη ευελιξία για το σχηματισμό παραλλαγών δισουλφιδικών δεσμών λόγω του μεγαλύτερου αριθμού δισουλφιδικών δεσμών της. Η IgG4 έχει επίσης μη κλασικές δομές δισουλφιδικών δεσμών. Η IgG1 έχει δύο κατάλοιπα προλίνης και η IgG4 περιέχει ένα κατάλοιπο προλίνης, το οποίο είναι ασταθές. Η αστάθεια των δισουλφιδικών δεσμών μεταξύ των βαρέων αλυσίδων της IgG4 της επιτρέπει να είναι διειδής in vitro. Ο αριθμός των δισουλφιδικών δεσμών και καταλοίπων επηρεάζει έτσι την ευελιξία μιας περιοχής άρθρωσης και μπορεί να επηρεάσει τις πιθανές διαμορφώσεις των βραχιόνων Fab και των περιοχών Fc. Ο αριθμός των αμινοξέων στις περιοχές άρθρωσης των IgGs είναι μεταβλητός: 15 στην IgG1, 12 στην IgG2, 62 στην IgG3 και 12 στην IgG4. Αν και οι περιοχές άρθρωσης τόσο της IgG2 όσο και της IgG4 περιέχουν 12 αμινοξέα, η έλικα πολυπρολίνης καθιστά την άρθρωση της IgG2 ακόμη πιο άκαμπτη. Στην IgG3, τα θραύσματα Fab βρίσκονται σχετικά μακριά από το θραύσμα Fc, αποδίδοντας μεγαλύτερη ευελιξία. Η ευελιξία των βραχιόνων Fab σε σχέση με τα τμήματα Fc ποικίλλει μεταξύ των υποκατηγοριών (IgG3 > IgG1 > IgG4 > IgG2) και αυτή η ευελιξία επηρεάζει την ικανότητα δέσμευσης αντιγόνου και το σχηματισμό ανοσοσυμπλεγμάτων. Είναι επίσης σημαντικό να σημειωθεί ότι μεγάλο μέρος της περιορισμένης βιβλιογραφίας σχετικά με τον λειτουργικό χαρακτηρισμό της δομικής δυναμικής και της σταθερότητας των αντισωμάτων των διαφορετικών ισομορφών ανοσοσφαιρίνης προέρχεται από μελέτες μεταλλαξιγένεσης που εξέτασαν τις επιδράσεις επιλεκτικών μεταλλάξεων συγκεκριμένων καταλοίπων της περιοχής των αρθρώσεων μέσω της παρατήρησης των επακόλουθων αλλαγών στην ευελιξία, τη σταθερότητα και τη δέσμευση των αντισωμάτων, με τα πρότυπα δισουλφιδίων και το μήκος των αρθρώσεων να αποτελούν παράγοντες που ενδεχομένως επηρεάζουν τη δυναμική φύση των διαφορετικών ανθρώπινων IgG.
Η τρέχουσα κατανόηση της δομικής δυναμικής των αντισωμάτων βασίζεται σε διάφορες μεθόδους. Όπως τονίζεται στην παρούσα ανασκόπηση, διάφορες τεχνικές απεικόνισης TEM μπορούν να χρησιμοποιηθούν για την απόκτηση της δυναμικής των IgG. Για παράδειγμα, η άμεση μέτρηση της γωνίας Fab-Fc-Fab από τις ληφθείσες 2D εικόνες, όπως φαίνεται στην Εικόνα 7H [61], η χαρτογράφηση μιας 3D δομής από την 2D εικόνα κάθε αντισώματος για ανάλυση γωνιακής ένδειας [83] και η 3D ανακατασκευή από κάθε μεμονωμένο αντίσωμα για ανάλυση φαίνεται στην Εικόνα 5 C[60]. Τόσο η 2D όσο και η 3D ανάλυση έδειξαν τον ίδιο μέγιστο πληθυσμό του αντισώματος, ενώ η 3D ανάλυση δείχνει μια πιο κοντά στην κατανομή Gauss και η 2D ανάλυση έδειξε υψηλότερο ποσοστό γωνιών πάνω από τη γωνία κορυφής. Επιπλέον, ο ρόλος της δέσμευσης αντιγόνου έδειξε αλλαγές στη δομή και τη δυναμική των δεσμευμένων IGGs όπως φαίνεται στο παραπάνω σύμπλοκο αντισωμάτων VLDL [69] και κάτω από τα συζευγμένα πεπτιδικά αντισώματα [29]. Μια λεπτομερής συζήτηση δημοσιεύθηκε πρόσφατα από τους Chen et al. [83].
Εικόνα 7. Η δομική δυναμική και οι αλλαγές διαμόρφωσης του IgG1 που είναι συζευγμένο με πεπτίδιο στο IPET. (Α) Τα σχήματα του πεπτιδίου που συζεύχθηκε με το αντίσωμα IgG1. (Β) Η άποψη της επισκόπησης του πεπτιδίου που συζεύγνυται με το IgG1. (Γ) Τα επιλεγμένα σωματίδια του IgG1 που παρασκευάζονται με τη μέθοδο OpNS. (Δ) Μέτρηση του μεγέθους και του σχήματος της περιοχής. Το αριστερό είναι μη συζευγμένο, το δεξιό είναι συζευγμένο. (E,F) Ιστόγραμμα του μεγέθους και του σχήματος της επικράτειας. (Ζ) Μέτρηση της γωνίας μεταξύ δύο περιοχών Fab, (Η) το ιστόγραμμα των γωνιών. Copyright© 2013 the Authors managed by Nature Publishing Group.
Έχουν αναφερθεί μέθοδοι χαρακτηρισμού που χρησιμοποιούν αναλύσεις αναγωγής, διαφορικής αλκυλίωσης, υγρής χρωματογραφίας και φασματοσκοπίας μάζας για τον χαρακτηρισμό της σειράς κατάταξης της ευαισθησίας των δισουλφιδικών δεσμών στα ανασυνδυασμένα αντισώματα. Έχει αποδειχθεί ότι η τροποποίηση αμινοξέων στην περιοχή άρθρωσης της IgG4 προκαλεί δομική μεταβολή. Οι Scapin et al. ανέφεραν τη δομή του θεραπευτικού pembrolizumab, ενός ανθρώπινου αντισώματος πλήρους μήκους IgG4 S228P κατά του PD1 σε ανάλυση 2,3Å [14]. Πρότειναν ότι μια συντομευμένη περιοχή άρθρωσης του pembrolizumab οδηγεί σε μια νέα διαμόρφωση εμποδίζοντας την ανταλλαγή του βραχίονα IgG4. Στο υπόλοιπο της παρούσας ανασκόπησης, επισημαίνουμε τις διαθέσιμες τεχνικές απεικόνισης που μπορούν να χρησιμοποιηθούν για την άμεση απεικόνιση των δομών των αντισωμάτων και τον καλύτερο χαρακτηρισμό των δυναμικών συμπεριφορών διαμόρφωσης.
Σε αυτή την επόμενη ενότητα, οι συγγραφείς αναγνωρίζουν ότι οι περισσότερες μέθοδοι απεικόνισης έχουν περιορισμούς όσον αφορά τον σαφή προσδιορισμό των τρισδιάστατων δομικών αλλαγών μετά τη σύζευξη. Παραδέχονται επίσης ότι η τρέχουσα μέθοδος IPET είναι ανεπαρκής για την παροχή δομών υψηλής ανάλυσης και για την ανίχνευση αλλαγών διαμόρφωσης στις περιοχές που καθορίζουν τη συμπληρωματικότητα (CDR) ως απόκριση στη δέσμευση αντιγόνου. Είναι σημαντικό να σημειωθεί ότι αυτοί οι «περιορισμοί» βασίζονται στις παραδοχές των ερευνητών σχετικά με το τι πιστεύουν ότι πρέπει να είναι σε θέση να «δουν». Τα ίδια τα σωματίδια, μαζί με τις διαδικασίες που τους αποδίδονται, είναι εντελώς μη παρατηρήσιμα και απαιτούν εκτεταμένο χειρισμό ακόμη και για να «οπτικοποιηθούν». Οι αφηγήσεις που κατασκευάζονται από αυτές τις έμμεσες μεθόδους και μετρήσεις μπορεί να μην έχουν καμία βάση στην πραγματικότητα, καθώς δεν αντικατοπτρίζουν πραγματικά τη φύση.
3.2. Τρισδιάστατη 3D Δομή και διαμορφωτικές αλλαγές συζευγμάτων φαρμάκων αντισωμάτων (ADC) από IPET
Το σκεπτικό για τη χρήση ADC στη φαρμακολογία εξηγείται από την ικανότητα χρήσης της φαρμακοκινητικής ενός αντισώματος για την αποτελεσματικότερη χορήγηση ενός προσαρτημένου φαρμάκου [95]. Τα επισημασμένα συζευγμένα αντισώματα μπορούν να χρησιμοποιηθούν για την αξιολόγηση της αποτελεσματικότητας του φαρμάκου ποσοτικοποιώντας την πρόσληψή τους στα κύτταρα [96,97]. Ωστόσο, λίγες εργασίες υπογραμμίζουν τη δομική δυναμική των ADC σε κλίμακα νανομέτρου λόγω των περιορισμών των περισσότερων μεθόδων απεικόνισης για τον σαφή εντοπισμό 3D δομικών αλλαγών μετά τη σύζευξη. Οι συνδυασμένες μέθοδοι IPET και OpNS, ωστόσο, συνεχίζουν να παρέχουν στοιχεία για την οπτικοποίηση και τον χαρακτηρισμό δομικών συμπεριφορών των ADC.
Μια μελέτη των Tong κ.ά. [61] χρησιμοποίησε ένα τροποποιημένο πεπτίδιο που συνδέεται ομοιοπολικά με τον βρόχο της συμπληρωματικής-καθοριστικής περιοχής (CDR) στην ανθρωποποιημένη h38C2 IgG1 (συζευγμένο αντίσωμα: CovX-body της Pfizer CovX LLC) ως μοντέλο για την προβολή εικόνων των αλλαγών διαμόρφωσης που συμβαίνουν λόγω της σύζευξης (Εικόνα 7). Χρησιμοποιήθηκαν τα πρωτόκολλα OpNS για τη λήψη εικόνων υψηλής ανάλυσης του συζευγμένου με πεπτίδιο IgG1 σε σύγκριση με το μη συζευγμένο IgG1 [71]. Το μέγεθος, το σχήμα και οι διακυμάνσεις του συζευγμένου και του μη συζευγμένου IgG1 αναλύθηκαν ποσοτικά και στατιστικά (Σχήμα 7). Παρόλο που τα μεγέθη των τομέων παρέμειναν σταθερά, οι εικόνες έδειξαν σημαντικές αλλαγές στο σχήμα του τομέα και διακυμάνσεις στο συζευγμένο αντίσωμα. Διαπίστωσαν ότι οι γωνίες F ab1 − Fc − Fab2 έγιναν στενότερες στο συζευγμένο IgG1, σε σύγκριση με το μη συζευγμένο IgG1, υποδεικνύοντας ότι ο χώρος μεταξύ των περιοχών Fab πιθανότατα περιορίστηκε λόγω της σύζευξης πεπτιδίων (Εικόνα 7). Αυτή η στένωση μπορεί να παρεμβαίνει στη σύνδεση του Fab με το αντιγόνο, η οποία θα μπορούσε επίσης να παρεμβαίνει στη σύνδεση του θραύσματος Fc με την FCγII ή την FcRn.
Η προσέγγιση IPET χρησιμοποιήθηκε στη συνέχεια με τον αλγόριθμο FETR για τη μετατροπή εικόνων OpNS 2D σε ανακατασκευασμένα 3D μοντέλα για κάθε μεμονωμένο σωματίδιο (Σχήμα 8). Οι περιοχές Fab1 − Fc − Fab2 του συζευγμένου IgG1 έδειξαν ένα επίμηκες, ραβδοειδές σχήμα σε σύγκριση με το μη συζευγμένο IgG1, οδηγώντας σε μια πιο άκαμπτη και δύσκαμπτη δομή. Αυτό υποδεικνύει ότι ο μηχανισμός της αλλαγής διαμόρφωσης που προκαλείται από το πεπτίδιο οφείλεται είτε στις στερικές επιδράσεις για την αντιστάθμιση των δύο α-ελίκων του πεπτιδίου με τον επαναπροσανατολισμό των περιοχών Fab και Fc είτε στις διαπλεκόμενες β-φύλλες της περιοχής Fab για την πρόκληση αλλαγών στην περιοχή Fc. Αυτό το «μοντέλο ενεργοποίησης» παρέχει μια εξήγηση για την απώλεια της λειτουργίας του δρώντα παράγοντα στην εξαρτώμενη από το αντίσωμα κυτταροτοξικότητα (ADCC) (Εικόνα 8) [95]. Οι δομικές μεταβολές που προκλήθηκαν από τη σύζευξη πιθανότατα προκάλεσαν αλλαγές στη φαρμακοκινητική, καθιστώντας την κάθαρση και την απομάκρυνση του αντισώματος φυσικά δύσκολη. Είναι ενδιαφέρον ότι το πρωτόκολλο IPET επιτρέπει εικόνα υψηλότερης ανάλυσης και ακριβέστερες μετρήσεις γωνίας από τις εικόνες 2D και ενισχύει περαιτέρω την ικανότητα παρακολούθησης των δυναμικών αλληλεπιδράσεων των αντισωμάτων μετά την παροχή φαρμάκου και διευκολύνει την αποτελεσματικότερη, αποδοτικότερη και ειδικότερη στόχευση φαρμάκων (Εικόνα 8). Ωστόσο, η τρέχουσα μέθοδος είναι ανεπαρκής στην παροχή δομών υψηλής ανάλυσης και αλλαγών διαμόρφωσης όσον αφορά τις περιοχές που καθορίζουν τη συμπληρωματικότητα (CDR) σε απόκριση στη δέσμευση αντιγόνου.
Εικόνα 8. Οι 3D χάρτες IPET της σύζευξης IgG1 και πεπτιδίων. (Α) Η διαδικασία της τρισδιάστατης ανακατασκευής IPET ενός μεμονωμένου σωματιδίου του σωματιδίου αντισώματος με σύζευξη πεπτιδίου, (Β) ο τελικός χάρτης πυκνότητας IPET 3D, (Γ) και το δομικό μοντέλο docked με προσομοίωση μοριακής δυναμικής. (Δ) Η διαδικασία μιας άλλης 3D ανακατασκευής IPET, (Ε) ο τελικός χάρτης τρισδιάστατης πυκνότητας IPET και (F) το προσδεδεμένο μοντέλο. (Copyright© 2015 the Authors, διαχείριση από τον εκδοτικό όμιλο Nature) (Ζ) Δύο αντιπροσωπευτικές διαμορφώσεις δύο μη συζευγμένων σωματιδίων αντισωμάτων. Η) Δύο αντιπροσωπευτικές διαμορφώσεις δύο συζευγμένων με πεπτίδιο σωματιδίων αντισωμάτων. (I) Σχηματική απεικόνιση του μηχανισμού της αλλαγής διαμόρφωσης που προκαλείται από τη σύζευξη πεπτιδίων.
Οι εικόνες που παρουσιάζονται εδώ είναι, για άλλη μια φορά, τρισδιάστατες ανακατασκευές που βασίζονται σε πιθανά τεχνουργήματα ή παραμορφώσεις. Οι συγγραφείς δείχνουν πώς η αρχική εικόνα "αποθορυβοποιείται" και στη συνέχεια τοποθετείται πάνω με το μοντέλο. Είναι ενδιαφέρον ότι ένα παράδειγμα της 2D IPET 3D ανακατασκευής είναι ενός μεμονωμένου "αντισώματος" που έχει σχήμα Χ. Προφανώς, τα "αντισώματα" παρουσιάζονται ως διάφορα γράμματα στο αλφάβητο.
3.3. Ποικιλία δομής διειδικών αντισωμάτων με IPET
Επειδή τα διειδικά αντισώματα μπορούν να αναγνωρίζουν ταυτόχρονα δύο διαφορετικούς στόχους, είναι έτοιμα να φέρουν επανάσταση στη βιοθεραπεία μέσω του βελτιωμένου χαρακτηρισμού και της μηχανικής. Σε αντίθεση με τα συμβατικά μονοκλωνικά αντισώματα, τα κουμπωτά διειδικά αντισώματα υπόκεινται σε αυξημένες δυνατότητες παραλλαγής, όπως ο ομοδιμερισμός σε ομοιοπολικές και μη ομοιοπολικές μορφές. Πρόσφατα, οι Zhang κ.ά. [62] αντιμετώπισαν μια μοναδική πρόκληση της παραγωγής και του χαρακτηρισμού διειδικών αντισωμάτων χρησιμοποιώντας τον συνδυασμό προσεγγίσεων ΗΜ και φάσματος μάζας για να αναλύσουν τις ευαίσθητες στην αποθήκευση και το pH μεταβολές του προφίλ της χρωματογραφίας υδρόφοβης αλληλεπίδρασης (HIC) για ένα ομοδιμερές διειδικό αντίσωμα από οπή σε οπή (Εικόνα 9Α, Β). Σε σύγκριση με αυτό το ασταθές ομοδιμερές Fc οπή-οπή υπό διαφορετικές συνθήκες αποθήκευσης, ένα διειδικό ετεροδιμερές, το οποίο χαρακτηρίστηκε με τις ίδιες μεθόδους και καθοδηγείται από τη συναρμολόγηση κόμβου-οπής, εμφάνισε σταθερή διαμόρφωση με ομοιογενή κατανομή, επιβεβαιώνοντας την επιθυμητή θεραπευτική του ποιότητα και παρέχοντας παράλληλα καλύτερη κατανόηση των παραλλαγών του ομοδιμερούς και του ετεροδιμερούς. Με την πρόοδο στη σκοπιμότητα και την προσβασιμότητα της ΗΜ μέσω μεθόδων όπως η OpNS και η IPET 3Ds (Εικόνα 9 Γ), υπάρχουν μεγάλες δυνατότητες εφαρμογής αυτών των μεθόδων υψηλής απόδοσης σε μεγαλύτερη κλίμακα για την επιτάχυνση της έρευνας για την παραγωγή των απαραίτητων θεραπευτικών αγωγών.
Εικόνα 9. Οι IPET 2D και 3D εικόνες του ομοδιμερούς οπής IgG (A) Δύο εκπρόσωποι ακατέργαστων εικόνων δύο αντισωμάτων σχήματος Υ και δύο εκπρόσωποι των μέσων όρων κατηγορίας αναφοράς των αντισωμάτων σχήματος Υ. (Β) Δύο εκπρόσωποι των ακατέργαστων εικόνων δύο αντισωμάτων σχήματος Χ και δύο εκπρόσωποι μέσων όρων κατηγορίας αναφοράς αντισωμάτων σχήματος Χ. Από πάνω προς τα κάτω, οι σειρές δείχνουν την αρχική εικόνα, την αποθορυβοποιημένη εικόνα τους, τοποθετημένη μαζί με το μοντέλο και το μοντέλο. Πνευματικά δικαιώματα© 2017 American Chemical Society. (Γ) Ένα παράδειγμα 2D IPET 3D ανακατασκευή ενός μεμονωμένου σωματιδίου αντισώματος σχήματος Χ. Η σειρά είναι ακατέργαστη εικόνα, προβολή ακατέργαστου 3D, προβολή τελικού 3D, τελικό IPET 3D και συνδεδεμένο μοντέλο.
Οι συγγραφείς καταλήγουν στο συμπέρασμα ότι η IPET προσφέρει πολλά υποσχόμενα στοιχεία ως η κορυφαία μέθοδος για τον προσδιορισμό της δομικής δυναμικής των σωματιδίων που αναγνωρίζονται ως «αντισώματα». Αναγνωρίζουν τους περιορισμούς των προηγούμενων μεθόδων, όπως οι προκλήσεις της κρυσταλλογραφίας ακτίνων Χ με την κρυστάλλωση δειγμάτων, η δυσκολία της φασματοσκοπίας NMR στην απεικόνιση μεγάλων μορίων, η δυνατότητα του NS EM για τη δημιουργία τεχνουργημάτων, οι δυσκολίες του cryo-EM στην απεικόνιση μικρών πρωτεϊνών (<100 kDa) λόγω του θορύβου και της μεροληψίας μοντελοποίησης και ο κίνδυνος του AFM για επιφανειακά τεχνουργήματα από τις αλληλεπιδράσεις δείγματος-υποστρώματος. Παρά τη χαμηλή της ανάλυση, ισχυρίζονται ότι η IPET είναι επί του παρόντος η μόνη πειραματική προσέγγιση που μπορεί να επιτύχει μια τρισδιάστατη εικόνα από ένα μόνο μικρό μόριο.
Ωστόσο, παρά τους ισχυρισμούς ότι η IPET είναι μια πολλά υποσχόμενη τεχνική, εξακολουθεί να αντιμετωπίζει σημαντικές προκλήσεις που εμποδίζουν τις δυνατότητές της. Οι εικόνες χαμηλής ανάλυσης που παράγονται είναι ιδιαίτερα ανοικτές στην ερμηνεία και η εξάρτηση από την ανακατασκευή με τη βοήθεια υπολογιστή εισάγει προκαταλήψεις στην τρισδιάστατη μοντελοποίηση. Επιπλέον, η υπόθεση ότι τα απεικονιζόμενα σωματίδια είναι πράγματι «αντισώματα», χωρίς σαφή στοιχεία καθαρισμού ή απομόνωσης καθώς και πειραματικά αποτελέσματα που να αποδεικνύουν τη λειτουργία, εγείρει σοβαρές αμφιβολίες για την εγκυρότητα των ευρημάτων. Η ερμηνεία αυτών των εικόνων βασίζεται συχνά σε προκατασκευασμένες αντιλήψεις σχετικά με τη δομή και τη λειτουργία των σωματιδίων και όχι σε άμεση παρατήρηση, γεγονός που θέτει υπό αμφισβήτηση την ακρίβεια και την αξιοπιστία των τελικών μοντέλων. Έτσι, αν και οι συγγραφείς υποστηρίζουν ότι η IPET προσφέρει μια νέα προσέγγιση, απέχει πολύ από το να αποτελεί μια οριστική μέθοδο για τη μελέτη πολύπλοκων σωματιδίων και τη διατύπωση πειστικών δηλώσεων σχετικά με την ταυτότητα και τη λειτουργία τους.
4. Μέλλον
Το IPET έχει αποδειχθεί ότι είναι ένα ισχυρό εργαλείο για την 3D απεικόνιση μιας μεμονωμένης πρωτεΐνης, όπως ένα αντίσωμα, και προσφέρει πολλά υποσχόμενα στοιχεία ως κύρια μέθοδος για τον προσδιορισμό της δομικής δυναμικής σε ανάλυση κοντά στο 1 nm. Αν και οι άλλες τεχνικές και μέθοδοι που συζητούνται εδώ έχουν δείξει τη χρησιμότητά τους στον χαρακτηρισμό της δομής των αντισωμάτων και της σύνθετης δομής αντισώματος-αντιγόνου, παραμένουν διακριτά μειονεκτήματα που εμποδίζουν την πρόοδό τους. Η κρυσταλλογραφία ακτίνων Χ περιορίζεται από δυσκολίες στην κρυστάλλωση του δείγματος, η φασματοσκοπία NMR παρουσιάζει δυσκολία στην απεικόνιση μεγάλων μορίων, η NS EM δημιουργεί πιθανά τεχνουργήματα, η cryo-EM παρουσιάζει δυσκολία στην απεικόνιση μικρών πρωτεϊνών (<100 kDa) λόγω θορύβου και πιθανής μεροληψίας 3D μοντελοποίησης και η AFM παράγει δυνητικά επιφανειακά τεχνουργήματα από αλληλεπιδράσεις δείγματος-υποστρώματος. Παρά τις εικόνες 3D χαμηλής ανάλυσης, το IPET είναι η μόνη γνωστή πειραματική προσέγγιση για την επίτευξη μιας 3D εικόνας από ένα μόνο μικρό μόριο, παρέχοντας τη δυνατότητα καλύτερου χαρακτηρισμού της μοριακής δυναμικής διαμόρφωσης. Αυτά δείχνουν συναρπαστικές δυνατότητες για την ολοκληρωμένη απεικόνιση αντισωμάτων και συμπλόκων αντισωμάτων-αντιγόνων για την πρόοδο της εφαρμοσμένης μοριακής βιολογίας, της ανοσολογίας και της φαρμακολογίας. Σημαντικό είναι ότι η IPET επιτρέπει την εξέταση δειγμάτων σε σχεδόν μητρική ρυθμιστική κατάσταση (όπως, π.χ., όταν είναι ενσωματωμένα σε υαλώδη πάγο) με βελτιωμένη ανάλυση χωρίς την ανάγκη επικάλυψης με βαρύ μέταλλο, που χρησιμοποιείται συχνά στην προσέγγιση NS. Με τον καλύτερο χαρακτηρισμό της δυναμικής και της δομικής συμπεριφοράς των αντισωμάτων, η τεχνική αυτή, μαζί με άλλες μεθόδους απεικόνισης, μπορεί να χρησιμοποιηθεί για τη σχεδίαση πιο στοχευμένων προσεγγίσεων για την ανάπτυξη θεραπευτικών ουσιών αντισωμάτων, βελτιώνοντας παράλληλα την αποτελεσματικότητα και τη βιωσιμότητα στην αντιμετώπιση της συνεχούς, διευρυνόμενης ανάγκης θεραπευτικών επιλογών για διάφορες ασθένειες.
https://www.mdpi.com/2073-4468/7/2/18/htm#B31-antibodies-07-00018

Αυτό που κατέστη σαφές από την έρευνά μου προσπαθώντας να βρω τις πρώτες εικόνες καθαρισμένων και απομονωμένων «αντισωμάτων» σχήματος Υ που έχουν ληφθεί απευθείας από ορό είναι ότι μια τέτοια προσπάθεια είναι σχεδόν αδύνατη. Αντ' αυτού, αυτό που ανακάλυψα ήταν σχήματα και αναπαραστάσεις για το πώς προτείνεται να μοιάζουν αυτά τα σωματίδια, που αναπτύχθηκαν επί πολλές δεκαετίες μέσω συμπερασμάτων από έμμεσες μεθόδους. Οι εικόνες TEM που βρήκα από τη δεκαετία του 2010 ήταν είτε εξαιρετικά ασαφή στιγμιότυπα σωματιδίων που ισχυρίζονταν ότι ήταν μονοκλωνικά «αντισώματα» είτε εμφανίζονταν ως τεχνουργήματα που διαμορφώθηκαν στο υποτιθέμενο σχήμα Υ μέσω τρισδιάστατης ανακατασκευής με τη χρήση αλγορίθμων υπολογιστή. Κάθε μέθοδος απεικόνισης αντιμετώπιζε τους δικούς της περιορισμούς, οι οποίοι έθεταν υπό αμφισβήτηση την εγκυρότητα των ευρημάτων που συνάγονται από τα δεδομένα.
Ενώ τα σωματίδια σχήματος Υ μπορεί να υπάρχουν στον ορό των ανθρώπων και των ζώων, τα στοιχεία που παρουσιάστηκαν δεν είναι πειστικά. Ακόμη και αν τα σωματίδια αυτά υπάρχουν, δεν υπάρχουν πειραματικά στοιχεία που να αποδεικνύουν ότι επιτελούν τις λειτουργίες που τους αποδίδονται. Το «αντίσωμα» σε σχήμα Υ είναι απλώς ένα λογότυπο - μια αναπαράσταση μιας υποθετικής οντότητας που χρησιμοποιείται για να εξηγήσει αποτελέσματα που παρατηρούνται στο εργαστήριο αλλά όχι στη φύση. Αυτό το λογότυπο έχει χρησιμοποιηθεί όχι μόνο για να υποστηρίξει την υπόθεση του «ιού» αλλά και για να προωθήσει την ιδέα ότι ο εμβολιασμός είναι ασφαλής και αποτελεσματικός και για να πουλήσει φαρμακευτικές θεραπείες που ισχυρίζονται ότι προστατεύουν από ασθένειες. Στο τέλος, κατέστη σαφές ότι το λογότυπο σε σχήμα Υ είναι απλώς μια πιασάρικη μασκότ που χρησιμοποιείται για την προώθηση της ιστορίας και την πώληση των προϊόντων στους καταναλωτές. Το κατά πόσον μια τέτοια οντότητα υπάρχει πραγματικά στη φύση παραμένει ένα μυστήριο.
Dr. Sam Bailey παρείχε μια εις βάθος ματιά στον «ιό» του Δυτικού Νείλου του Anthony Fauci.
Οι Bailey's έκαναν επίσης μια ειδική βιντεοπαρουσίαση ενός από τα δοκίμια του δημοσιογράφου, δοκιμιογράφου και μυθιστοριογράφου Paul Cudenec «Η διαφθορά είναι πραγματική και αρρωστημένη».
H Amandha Dawn Vollmer παρουσίασε μια εξαιρετική επανεξέταση της απάτης "αντισωμάτων" στην τελευταία της δημοσίευση.
Η Christine Massey FOI κατέθεσε μερικές διαφωτιστικές απαντήσεις βάσει του Νόμου για την Ελευθερία της Πληροφόρησης σχετικά με την ανυπαρξία του υποτιθέμενου “ιού” της “πανώλης των αιγοπροβάτων” - Peste des Petits μηρυκαστικά "Ιός"
"SARS-COV-2:"
Dawn Lester εξέτασε πώς η αφήγηση του «SARS-COV-2» έχει αναστραφεί από τη διαρροή εργαστηρίου σε ένα ξέσπασμα ζώων, προκειμένου να δημιουργηθεί σύγχυση.
Εξέτασε επίσης την τρέχουσα προπαγάνδα στα πρωτοσέλιδα.
Danni Møller Βάλτε στο προσκήνιο τον εμβολιασμό με δύο από τα τελευταία άρθρα του.
Unbekoming πήρε συνέντευξη από τον Michael Allen Bryant, ανεξάρτητο δημοσιογράφο/ακτιβιστή και ερευνητή, σχετικά με την ανύπαρκτη «πανδημία».
Έκανε επίσης μια έκθεση για τον «ιό» του Έμπολα, χρησιμοποιώντας ακόμη και το λογότυπο του εμπορικού σήματος στον τίτλο (τα μεγάλα μυαλά σκέφτονται το ίδιο 😁).
Αν σας άρεσε αυτό το άρθρο και θα θέλατε να βοηθήσετε να στηρίξετε το συνεχές έργο μου, ο παρακάτω σύνδεσμος είναι μια επιλογή.
Παρακαλώ βοηθήστε να στηρίξετε το έργο μου. 🙏
---Δικτυογραφία :
The Antibody™ - by Mike Stone - ViroLIEgy Newsletter